
点击蓝字 关注我们

微末生物
Nanomega CryoAI
在神经退行性疾病如帕金森病、路易小体痴呆和多系统萎缩症的研究中,α-突触核蛋白(α-Syn)聚集形成的纤维状结构一直是一个重要的研究主题。近年来,科学家发现,这些α-Syn纤维不仅与这些疾病的发生密切相关,而且它们的形态和结构可能会影响疾病的进展和病理特征。然而,尽管我们已经了解了许多关于α-Syn聚集的机制,具体这些纤维如何影响疾病,依然存在许多未解之谜。
为了揭开α-Syn的神秘面纱,加州大学洛杉矶分校(UCLA)的周正洪教授团队通过冷冻电镜技术(cryo-EM)解析了它们的原子级结构,成功揭示了两种主要的α-Syn纤维形态——“棒状”和“螺旋状”,为理解α-Syn在神经退行性疾病中的毒性及其传播机制提供了新的视角,同时也为未来针对α-Syn聚集的药物设计指明了方向。文章Cryo-EM of full-length α-synuclein reveals fibril polymorphs with a common structural kernel 于2018年9月6日发表在Nature Communications 上。
α-Syn:
神经退行性疾病的“幕后黑手”
α-Syn是一种内在无序的蛋白质,它能够自发聚集形成纤维状结构,称为“聚集体”(polymorphs)。这些聚集体不仅能够招募并转化其他正常的α-Syn单体,还能够在大脑中传播,引发神经退行性疾病。这一过程被称为“种子效应”(seeding),它是导致α-Syn在帕金森病、路易小体痴呆和多系统萎缩症等疾病中传播的关键因素。
不同形态的α-Syn纤维展现出不同的种子效应。在体外实验中,研究发现,某些α-Syn聚集体能够更高效地引发疾病相关的神经损伤,进而影响疾病的进展。然而,尽管科学家们已经研究了不同形态的α-Syn纤维在实验室中的行为,但这些聚集体的原子级结构差异却一直未被揭示。
揭开面纱:
冷冻电镜揭示两种主要纤维形态
在这项研究中,研究人员采用了冷冻电镜技术(cryo-EM)来解析α-Syn纤维的原子级结构,并成功识别出两种主要的聚集体形态:棒状(rod)和螺旋状(twister)。这两种形态的纤维原型共享一个共同的“核心结构”—— 一种弯曲的β-弓形结构。对于棒状纤维,能够清晰地看到60个氨基酸(L38-K97)形成了一个“希腊钥匙”形状的核心结构,而在螺旋状纤维中,仅有41个氨基酸(K43-E83)呈现有序结构,形成一个弯曲的β-弓形(图1)。这表明,尽管这两种纤维的结构有些不同,但它们共享相同的基本原纤维核心。
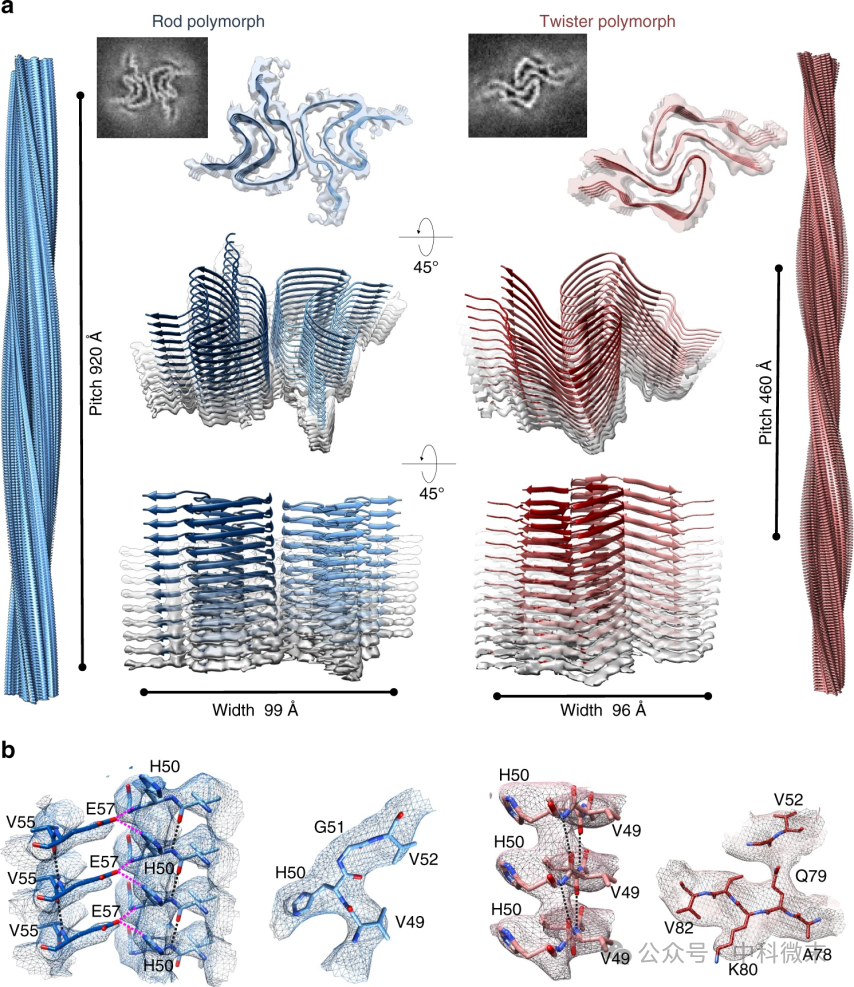
图1:aSyn棒状和螺旋状纤维的冷冻电镜结构及其原子模型a,左侧为棒状(蓝色)aSyn纤维,右侧为螺旋状(红色)aSyn纤维,显示其三维结构及相应的原子模型。两者都由两条原纤维组成,呈现21螺旋对称轴,并且都具有2.4Å的螺旋升高。
b,模型验证:显示两种多形态的冷冻电镜密度图与相应的原子模型对比,侧链与冷冻电镜密度图之间的匹配情况。
具体而言,棒状纤维和螺旋状纤维在各自的β-sheet原型之间的接触区域不同,棒状纤维的接触位点集中在NACore区域,而螺旋状纤维则主要集中在preNAC区域。这种差异不仅影响了纤维的整体形态,还可能在不同的神经退行性疾病中发挥不同的病理作用。
毒理揭秘:两个病理路径
接下来,研究人员进一步通过细胞实验验证了aSyn纤维种子的病理相关性。他们使用了HEK293T细胞,这些细胞内源性表达与帕金森病相关的aSyn A53T突变,并通过FRET分析定量测量了细胞内聚集物的水平。即使在10nM的低浓度下,aSyn纤维种子也能诱导细胞内形成荧光斑点状的aSyn聚集物(见图2c)。
FRET信号显示,细胞内的aSyn聚集物呈剂量依赖性增加(图2d)。此外,研究还评估了这些aSyn纤维对PC12神经细胞的细胞毒性,发现500nM浓度下的aSyn纤维具有显著的细胞毒性(图2e)。这表明,研究中使用的aSyn纤维不仅能够作为种子诱导细胞内淀粉样聚集,还能引发细胞毒性反应。
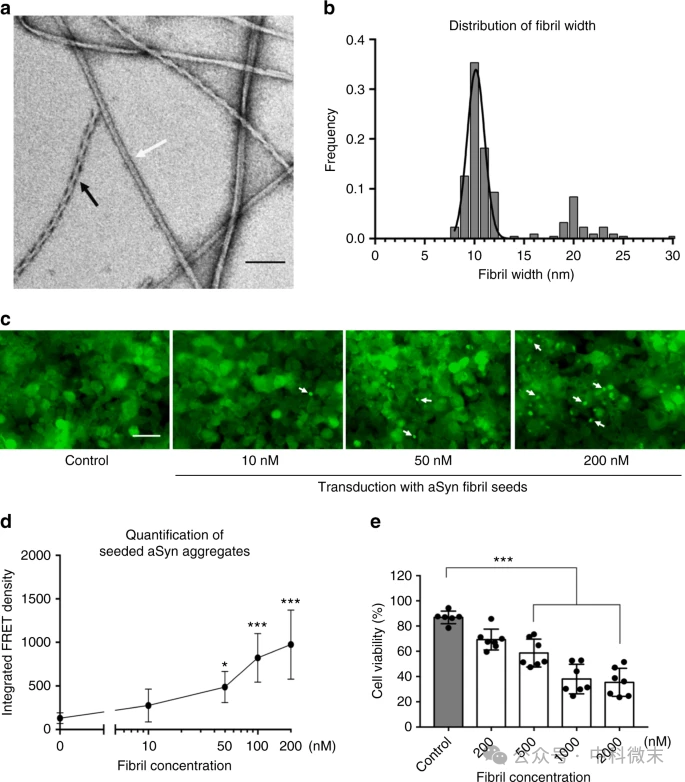
图2:aSyn纤维的不同形态及其在体外种子和细胞毒性中的作用a和b:负染色电子显微镜观察到的两种aSyn纤维形态:棒状(白箭头,未扭曲)和螺旋状(黑箭头,扭曲),纤维宽度约10nm。c和d:FRET分析的内源性aSyn聚集物。c为FITC通道荧光图像,显示aSyn聚集物为亮点(白箭头)。d为FRET定量分析,显示aSyn纤维种子诱导的细胞内聚集。
e:MTT细胞活性实验评估aSyn纤维的细胞毒性。500nM浓度下,aSyn纤维对PC12神经细胞有显著毒性(p
纤维多形态与突变:
家族突变如何影响结构
上述内容中提及,研究发现aSyn纤维的两种多形态之间存在显著的不同。进一步通过比较冷冻电镜结构,研究人员发现棒状和螺旋状纤维的原纤维之间的接合界面有所不同。棒状纤维的接合界面由preNAC区域的氨基酸残基形成,而螺旋状纤维则主要由NACore区域的氨基酸残基形成。这些不同的接合方式可能是导致这两种纤维形态差异的原因。
棒状纤维的结构与几种与帕金森病相关的家族突变(如E46K、A53T等)有一定的关联。研究表明,这些突变可能会破坏棒状纤维的结构稳定性,而对于螺旋状纤维,则影响较小(见图3)。这为我们理解aSyn纤维在神经退行性疾病中的作用提供了新的线索。
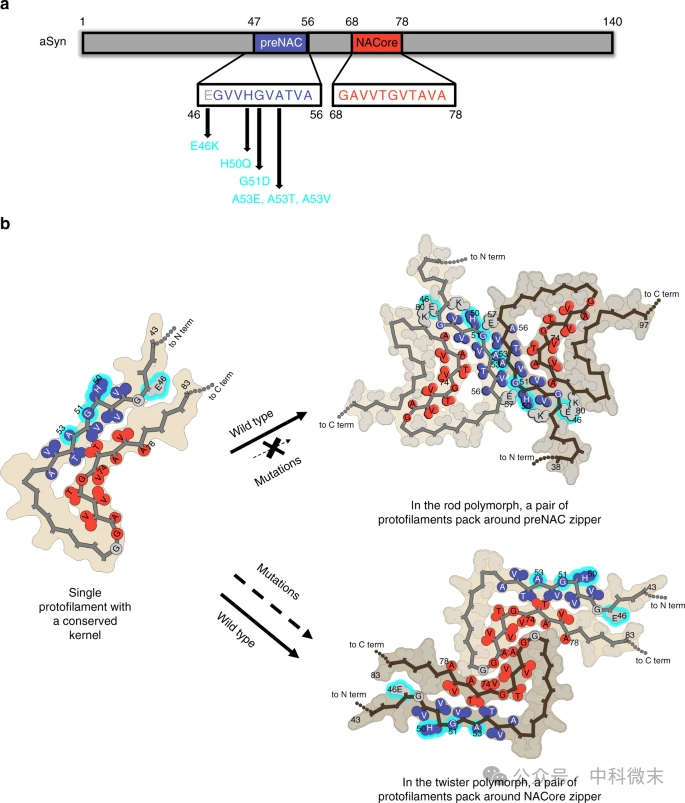
图3:aSyn纤维多形态的形成机制与家族突变的关系
a,显示preNAC(蓝色)和NACore(红色)区域的氨基酸序列以及与帕金森病相关的家族突变。
b,棒状和螺旋状纤维的原纤维接合界面,显示家族突变如何影响aSyn纤维的多形态结构。
临床应用与未来方向
这一研究不仅揭示了α-Syn纤维的多形态结构,也为我们未来在药物设计中的潜在策略提供了新思路。研究人员认为,针对不同纤维形态的药物可能有助于抑制α-Syn的聚集和传播,从而减缓神经退行性疾病的进程。
棒状和螺旋状两种纤维结构的形成与aSyn的特定区域—前NAC(preNAC)和NACore—的相互作用密切相关。研究表明,这些区域在纤维的形成中起着关键作用,这些区域不仅影响纤维的形态,还可能成为潜在的治疗靶点,通过阻止这些区域的结合,可能有效阻止aSyn的聚集过程,从而为治疗帕金森等神经退行性疾病提供新的治疗策略。
此外,研究还揭示某些突变可能减少棒状纤维的数量,并促进螺旋状纤维的形成,这一变化可能与患者的临床表现以及病理状态密切相关。因此,深入了解每种纤维多态性的生物学功能,将有助于我们理解其在神经退行性疾病中的作用,并为未来基于结构的治疗设计提供指导。
总结
α-Syn蛋白的聚集是神经退行性疾病中的一个重要因素。研究通过冷冻电镜技术揭示了两种主要的α-Syn纤维形态:棒状和螺旋状。这些不同形态的纤维在结构上的差异,可能导致它们在疾病中的作用也有所不同。研究还表明,家族突变可能会通过改变纤维结构,加剧疾病的进展。这些发现不仅深化了我们对α-Syn蛋白聚集机制的理解,也为未来的治疗策略提供了重要的线索。
鑫研微末团队在生物大分子及其复合体的三维结构解析方面具有技术领先、经验丰富的优势。我们采用先进的冷冻电镜和冷冻电子断层扫描技术,能够在原子级分辨率下精确解析多种生物大分子的三维结构,为微生物学和生物技术应用提供了全新的视角。团队的技术实力和前沿的研究方法使我们能够深入探索细胞生物学的未解之谜,推动神经科学及相关药物设计的突破性进展。
微末生物
Nanomega CyroAI
欢迎加入公司冷冻电镜技术讨论群 一起讨论
添加公司客服马老师微信,备注“加群”
期待与您交流!

周正洪和Lin Jiang为本文通讯作者,
Binsen Li、Peng Ge、Kevin A. Murray为共同第一作者。
原文链接:
https://www.nature.com/articles/s41467-018-05971-2#Sec7
点击“阅读原文”,查看文章↓
内容中包含的图片若涉及版权问题,请及时与我们联系删除

