
点击蓝字 关注我们

微末生物
Nanomega BioAI
埃博拉病毒(EBOV)作为一种致命的出血热病原体,其核衣壳蛋白(eNP)在病毒生命周期中扮演着至关重要的角色。eNP 不仅组装成核衣壳(NC),保护病毒 RNA 基因组并作为 RNA 合成的模板,还与其他病毒蛋白相互作用,参与病毒颗粒的形成。然而,关于 eNP 的具体组装机制以及其在病毒 RNA 合成中的调控作用,目前仍知之甚少。
2018年,华盛顿大学医学院(Washington University School of Medicine)的Gaya K. Amarasinghe教授团队与加州大学洛杉矶分校(UCLA)的周正洪教授等合作者,通过冷冻电子断层扫描技术解析eNP 核衣壳样管状结构的5.8 Å 分辨率三维结构,在Cell上发表了论文Electron Cryo-microscopy Structure of Ebola Virus Nucleoprotein Reveals a Mechanism for Nucleocapsid-like Assembly。他们揭示了 eNP 聚合、RNA 结合以及核衣壳样组装的分子机制,并提出了抗病毒药物的新靶点。
研究背景
eNP 是一种结构灵活的蛋白质,其 N 端和 C 端具有不同的功能。N 端区域(残基 1-450)在副黏病毒和丝状病毒中高度保守,而 C 端区域(残基 451-739)则是丝状病毒所特有的。先前的研究表明,eNP N 端可以形成反向双环结构的低聚物,并进一步组装成管状结构。此外,eNP与其他病毒蛋白,如 VP35 和 VP24,以及宿主因子之间的相互作用,也参与了 eNP 的组装和功能。
研究方法
本研究采用了生化与结构生物学结合的方法,包括生化分析、冷冻电子断层扫描技术以及分子动力学模拟,来解析 eNP 核衣壳样管状结构的组装机制和功能调控。
1. 生化分析:
凝胶过滤层析 (SEC):用于分离 eNP 低聚物和单体。
动态光散射 (DLS):用于测定 eNP 低聚物的尺寸分布。
多角度激光散射 (MALS):用于测定 eNP 低聚物的分子量。
氢氘交换质谱 (HDX-MS):用于研究 eNP 低聚物和 RNA 结合对蛋白质结构的影响。
2. 冷冻电子断层扫描技术:
数据采集:使用冷冻电子显微镜(Cryo-EM)在 5.8 Å 分辨率下收集 eNP 核衣壳样管状结构的电子透射照片。
结构解析:螺旋重构(helical reconstruction)。通过迭代螺旋重建算法 (IHRSR) 确定螺旋参数,并进行 3D 重建。
模型构建:使用 UCSF Chimera 软件进行蛋白质模型的分割和拟合,并进行 MDFF 模拟进行结构优化。
3. 分子动力学模拟:
Markov 状态模型 (MSM):用于研究 eNP 在溶液中的构象多样性。
MDFF 分子动力学柔性拟合:用于研究 eNP 低聚物和 RNA 结合对蛋白质结构的影响。
研究结果
1. eNP蛋白 N 端和C端模块是低聚物形成的必要条件:
SEC 和 DLS 实验表明,eNP-2 低聚物存在两种不同的尺寸分布(图1,B-C),分别对应于管状结构和环状结构。
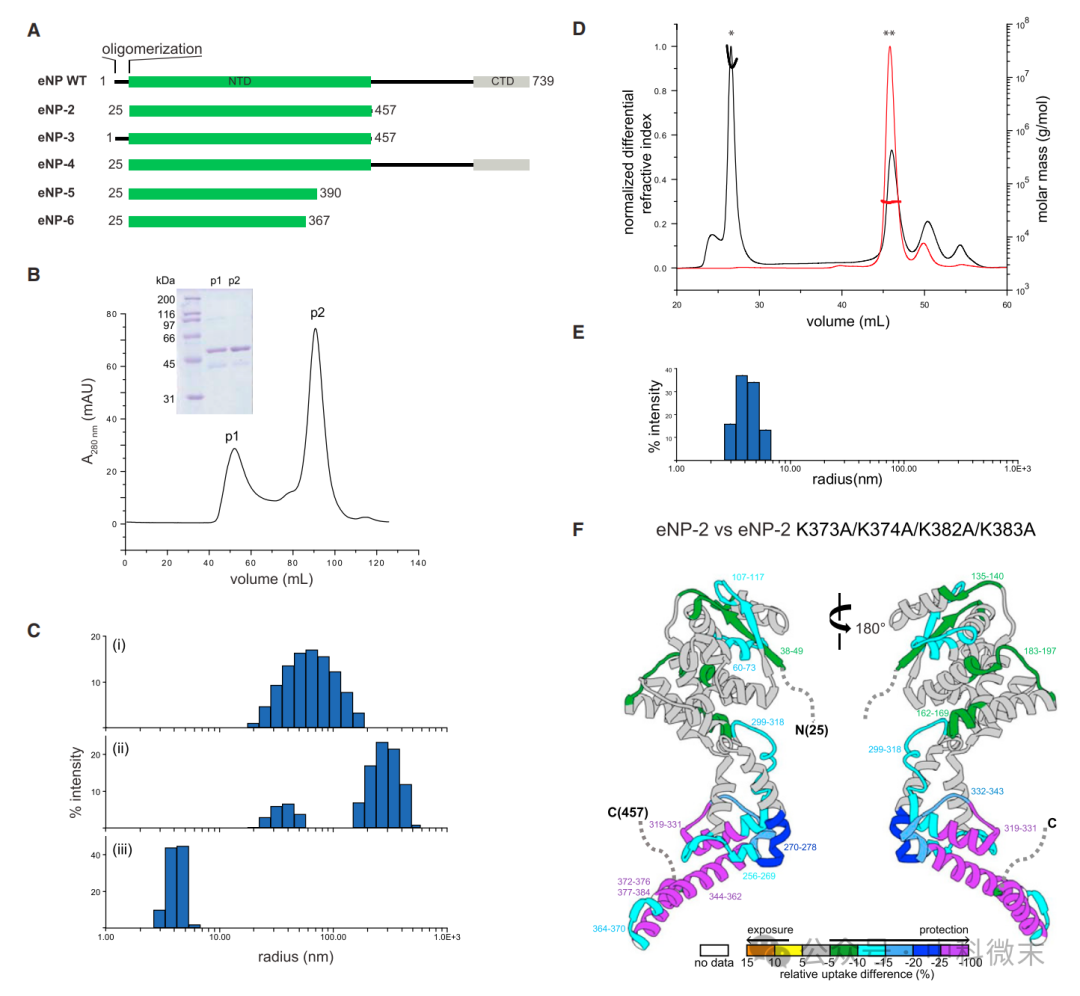
图1:eNP N 端是低聚物形成的必要条件。eNP2-6表示不同形式的截断突变体(图1A)
eNP-2 K373A/K374A/K382A/K383A 突变体由于 a22 螺旋中保守赖氨酸残基的突变而无法形成低聚物(图1,D-E)。
HDX-MS实验表明,eNP-2 K373A/K374A/K382A/K383A 突变体的 a21 和 a22 螺旋暴露于溶剂中,表明该突变体处于游离状态(图1,F)。
2. eNP 低聚物通过 a21 和 a22 螺旋介导:
a21 和 a22 螺旋中保守赖氨酸残基的突变导致 eNP 无法形成低聚物,并降低了 ssRNA 结合能力(图2)。
eNP-3与eNP-2 K373A/K374A/K382A/K383A 突变体相比,ssRNA 结合能力更强,表明 a21 和 a22 螺旋对于 ssRNA 结合至关重要。
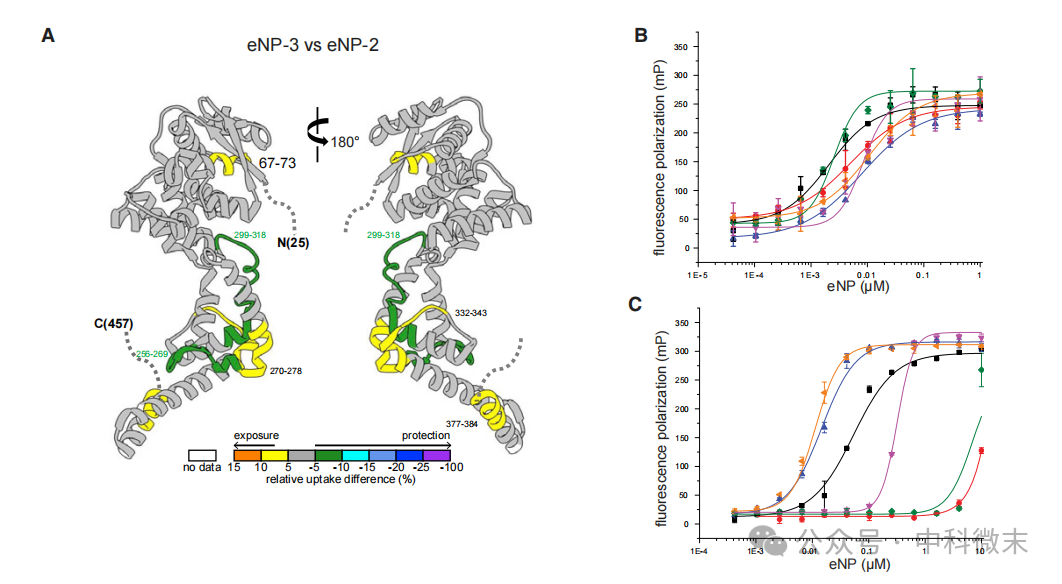
图2:B-C联系上下文的调节模块(context-dependent regulatory module,CDRM)调节了eNP的功能
3. eNP 低聚物的结构变化促进其与ssRNA 结合:
eNP-2 与 ssRNA 结合时,a22-a23 区域的氢氘交换率显著降低,表明该区域在 RNA 结合过程中发生结构变化(图3)。
eNP-3 与 ssRNA 结合时,N 端区域的氢氘交换率显著降低,表明 N 端区域在 RNA 结合过程中发生结构变化。
eNP-2/ssRNA 与 eNP-3/ssRNA 的氢氘交换模式相似,表明 N 端区域对 RNA 结合的整体影响有限。
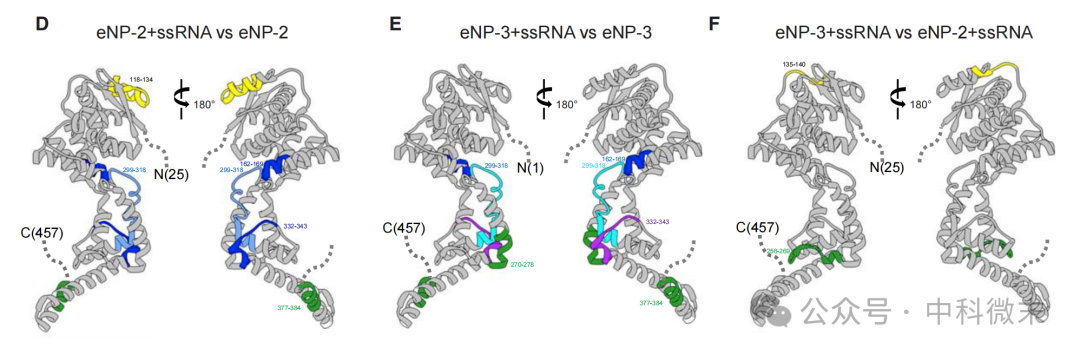
图3: eNP-2或-3与ssRNA结合前后的HDX-MS实验结果对比
4. eNP-2 形成由异二聚体 eNP 亚基组成的螺旋管状结构:
冷冻电子透射和螺旋重构技术解析了 eNP-2 核衣壳样管状结构的 5.8 Å 分辨率三维结构,该结构呈左手螺旋管状(图4)。
每个不对称单元由两个 eNP 分子组成,称为 a 和 b。
b 分子由其独特折叠的 a23 螺旋与 a 分子的β发夹结构相互作用,该结构也参与了 VP35 NPBP 的结合。三维结构的解析提示a22和a23螺旋对蛋白复合物的形成起更加复杂的调节作用。
eNP-2 螺旋管状结构在管内和管外都存在 RNA 结合沟槽。
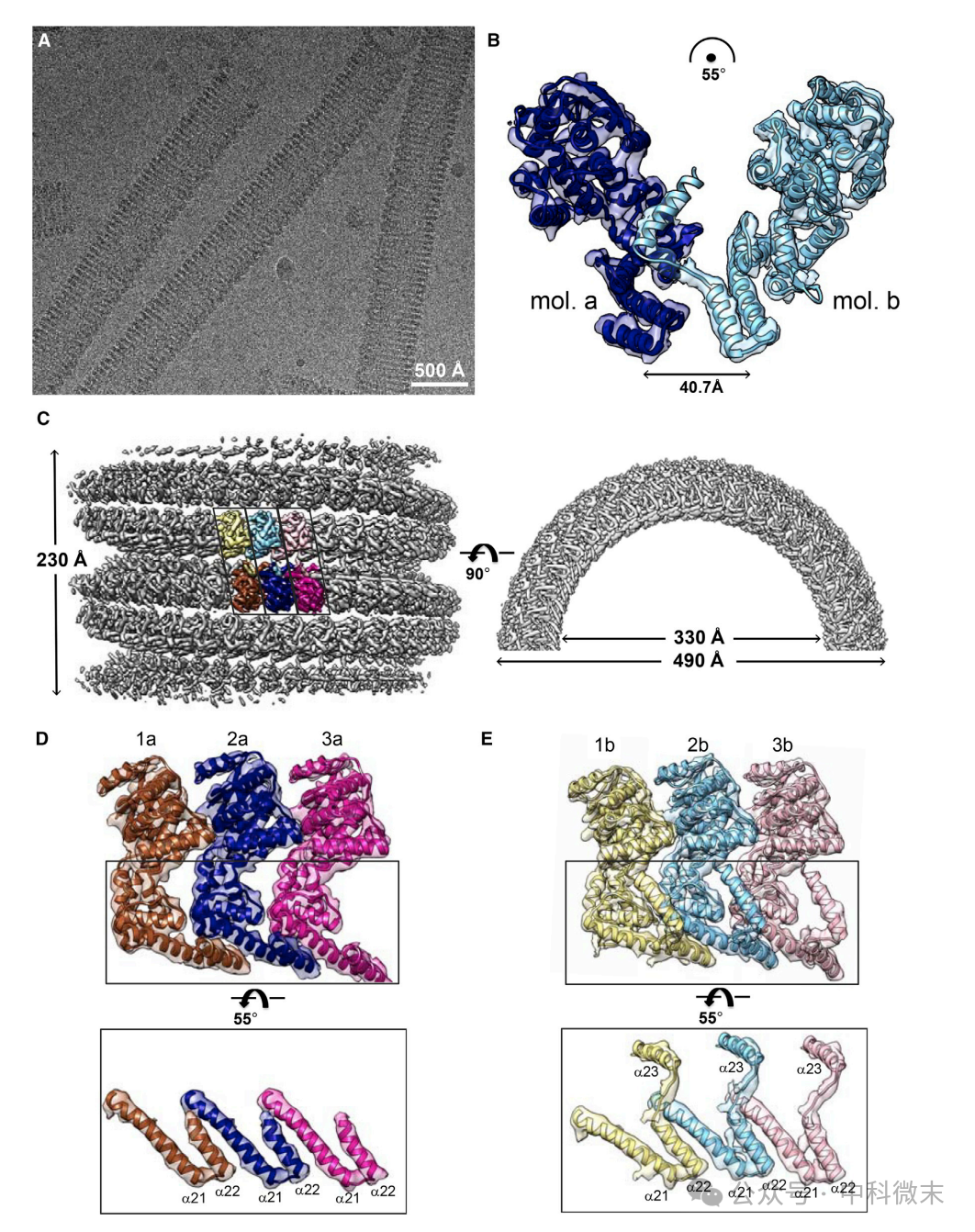
图4:eNP复合体类核衣壳结构的低温电子显微镜螺旋重建
5. 使用显性负性突变体1的检测方式判断a22和a23蛋白的效应:
eNP C 端 (eNP 1-384) 或 N 端 (eNP 385-739) 的缺失导致病毒 RNA 合成功能丧失。eNP K373A/K374A/K382A/K383A 突变体反而能够支持更高水平的病毒 RNA 合成(图5,A)。
eNP 1-384 和 eNP D385-412 突变体能够竞争性抑制野生型 eNP 的功能,而 eNP 413-739 突变体和eNP K373A/K374A/K382A/K383A 突变体则无法抑制(图5,B)。
这些结果表明,病毒RNA的合成依赖于eNP的寡聚化,而a22中的 K373/K374/K382/K383 残基(而不是 a23 中的残基)对于与 WT 野生型蛋白和突变 eNP 蛋白形成的 eNP-eNP 寡聚体竞争非常重要(图5,C)。如果这些残基都发生突变,突变eNP蛋白将无法和野生型蛋白竞争性地形成寡聚体。
注意到,eNP K373A/K374A/K382A/K383A(a22 中的突变)在实验中无法抑制 eNP 活性,这表明虽然这个构建体能够支持病毒 RNA 合成,但 a22 CDRM 的丢失阻止了显性负性活性。一个可能的解释是,野生型 eNP 形成的 eNP 低聚物与其他突变 eNP 构建体不同,并且对 ssRNA 模板具有更高的亲和力。我们的模型认为,由 活性CDRM 驱动构成的低聚物促进了更高的 RNA 模板亲和力,因此为病毒 RNA的合成过程带来了更高活性。
eNP-2 与 eNP-5(缺失a23系列残基)之间的 ssRNA 结合力相差约 4 至 5 倍,而 eNP-6 由于缺少 a22-a23 的所有残基,ssRNA 结合力几乎完全丧失。这些结果表明,a23 中的残基对 ssRNA 结合起一定作用(但微乎其微)。
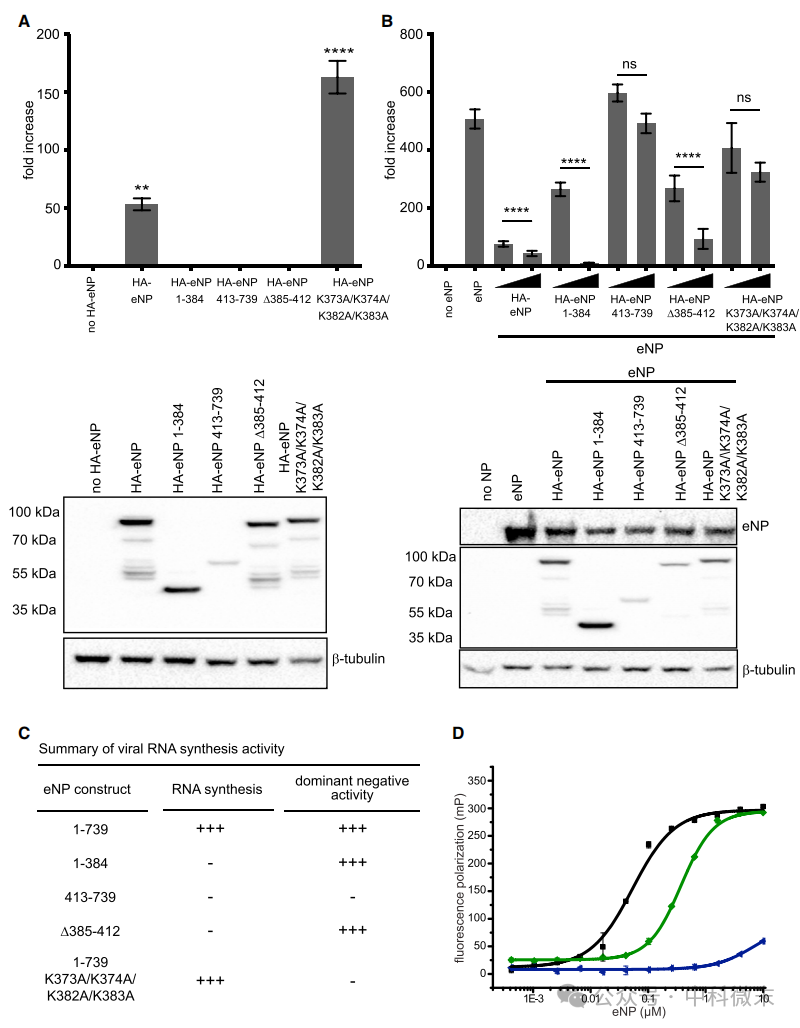
图5:C 端螺旋 a23 或是调控 eNP 病毒 RNA 合成的 CDRM模块之一。(K373A/K374A/K382A/K383A是对a22螺旋基本氨基酸的系列突变。)
6. eNP 表现出构象异质性:
分子动力学模拟表明,eNP 在溶液中表现出广泛的构象异质性,尤其是在 a21-a22 螺旋区域。
模型中存在一些构象,其a22螺旋卷曲成一种可以与 RNA 相互作用的构象。
病毒蛋白eVP35 NPBP 可能通过阻止螺旋折叠成允许 RNA 相互作用的构象来抑制 eNP 低聚物形成。
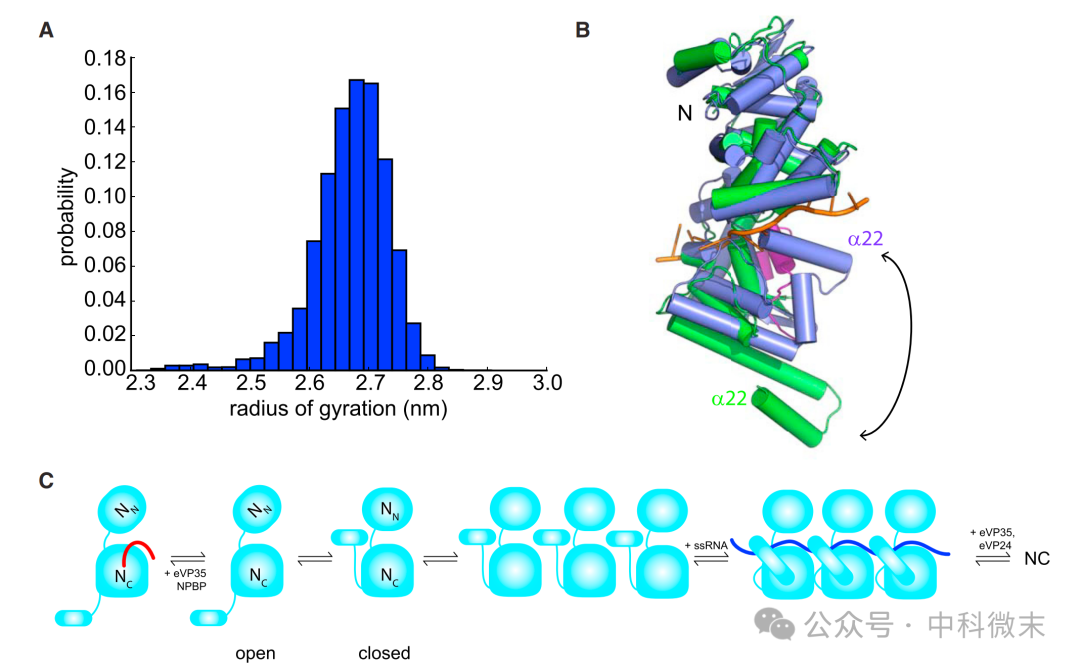
图6:分子动力学模拟表明了eNP的构象异质性
研究结果分析&意义
本研究综合采用生物化学和结构生物学方法,验证了生化研究和冷冻电子断层扫描重建中发现的称为 CDRM 的新调控元素的功能影响。本研究揭示了 eNP 核衣壳样组装的分子机制,并提出了抗病毒药物的新靶点。
冷冻电子断层扫描结构中 eNP 的整体架构与 eVP35-NPBP 结合的 eNP X 射线晶体结构相似。然而,eNP N 端和 C 端分别形成了一个名为“情境/上下文依赖性调控模块 (CDRM)”的结构域,而平衡、动力和结构实验表明,NC 组装中的 eNP 需要通过 CDRM 进行相互作用,例如a22-a23 螺旋。
CDRM 通过控制 eNP 低聚物形成来调节 eNP 对病毒基因组 RNA 模板的结合,从而影响病毒 RNA 合成。
研究人员通过冷冻电子断层扫描技术获得了eNP核衣壳样管状结构的5.8 Å分辨率的三维结构,揭示了eNP螺旋 a22-a23 对于病毒核衣壳组装和病毒RNA合成的调节作用。该研究为理解埃博拉病毒核衣壳组装的分子机制提供了新的框架,并为抗病毒药物开发提供了新的靶点。CDRM 结合口袋可以作为抗病毒药物的新靶点,因为它们代表了动态采样和功能相关的构象;而开发针对 CDRM 结合口袋的肽类似物或小分子抑制剂可以干扰病毒 RNA 合成,从而抑制病毒复制。
总结而言,本研究利用冷冻电镜解析eNP NC 复合物的三维结构,为理解 eNP 核衣壳样组装的分子机制提供了重要的见解,并为开发针对埃博拉病毒和其他负链 RNA 病毒的抗病毒药物提供了新的思路。中科微末团队在生物大分子及其复合体的三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
1、显性负性突变:凡一对等位基因中因其中一个突变或丢失所致的另一个正常等位基因的功能活性丧失,都称为显性负突变.换言之,显性负突变即杂合的突变产生了纯合突变的效应.例如,在某些肿瘤中,抑癌基因p53的一个等位基因的失活导致另一个正常等位基因也失去活性.机理是突变型蛋白和相关蛋白形成无功能的二聚体(或多聚体),野生型蛋白功能被一并抑制。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流

