
点击蓝字 关注我们

微末生物
Nanomega BioAI
前言
我们无时无刻不在与所处的世界交互,从日常的社交接触:握手、拥抱,到与家庭成员共享生活;从闲暇时强身健体参与体育运动,到日常通勤穿梭于汹涌人潮,我们都处于人与人之间的亲密接触、共用物品以及公共场所的活动中。直接接触传播在日常生活中的普遍性体现在以上这些生活场景中。许多病毒就在这样的直接接触过程中找到了传播途径。
HSV-1(Herpes Simplex Virus Type 1)即单纯疱疹病毒1型就主要通过直接接触传播,如接吻、共用餐具、接触唾液或其他体液,也可以通过口腔性接触传播。HSV-1感染的主要症状和表现如口唇疱疹、眼部感染和脑炎。由于此类疱疹病毒可以在人体内长期潜伏并定期复发,感染者可能在其一生中反复出现疱疹症状,给生活带来不便和困扰。而对于免疫系统受损的个体(如艾滋病患者或器官移植患者),HSV-1感染可能导致更严重的并发症,如扩散性感染或内脏器官损害。单纯疱疹病毒1型是全球范围内非常普遍的病毒,多数人一生中会感染一次,它也因此成为了许多人的“噩梦”。
HSV-1是典型的人类单纯疱疹病毒,在感染细胞时,病毒的外膜与细胞膜融合,释放内部的病毒成分进入细胞内,病毒的DNA会被送到细胞核中,在那里进行复制和转录。感染后表现出多种临床症状,从反复发作的口腔溃疡到更严重的疾病如失明和脑炎。接受器官移植或患有艾滋病等免疫抑制的个体特别容易受到潜伏的疱疹病毒感染重新激活引起的生命威胁性并发症的影响。
1250Å直径的单纯疱疹病毒-1(HSV-1)是目前研究过的最大的病毒结构之一,其衣壳由四种主要结构蛋白组成,其中VP26(约12,000摩尔质量)是最小的。1995年,通过使用400 kV电子冷冻显微镜和计算机重建技术,研究人员确定了野生型和重组杆状病毒的HSV-1衣壳三维结构。他们发现,VP26六聚体附着在野生型病毒衣壳所有形为六角体的亚基顶端,由一个较大的结构域和一个较小的结构域组成。
基于VP26与六角体亚基的相互作用,来自加州大学洛杉矶分校微生物学、免疫学和分子遗传学系的周正洪教授及其团队在本研究中通过电子显微镜和计算机技术研究了VP26组装的机制,这帮助科学家了解了病毒外壳的组成和蛋白质的具体位置,并初步建立关于HSV外壳结构的假设。文章发表在Nature Structural Biology(现为Nature Structural & Molecular Biology)上。
一、“看”清病毒蛋白VP26
研究人员通过基于重组杆状病毒的系统生成缺少VP26的病毒颗粒,对其三维结构、位置和作用进行了详细分析。结果表明:尽管缺少VP26的病毒衣壳在整体大小和对称性上与正常病毒外壳相似,但在外壳顶角的六边形区域中发现了显著的差异(图1,b)。这些差异主要表现为一种额外的密度,这种密度差异被归因于VP26蛋白的缺失。进一步的分析确认了VP26蛋白的位置,它位于六角体的顶部,并通过一种环状结构与其他外壳蛋白(如VP5)相互作用。VP26蛋白由两个部分组成,并在不同的六角形区域可能采取不同的构象。由于分辨率限制,当下无法完全确定VP26蛋白的具体结构,但研究结果已经表明,VP26在病毒外壳的稳定性和功能中起到了关键作用。它不仅参与了外壳的结构连接,还可能在病毒的组装和感染过程中扮演重要角色。这个发现为推动理解HSV-1病毒的组装机制和抗感染研究提供了重要线索。

图1:比较重组和野生型衣壳的结构。
a、重组HSV-1 缺乏VP26衣壳的3D结构表面表示(分辨率为19Å);
b、野生型B衣壳和重组缺失VP26衣壳重建的差异图。该二十面体壳由12个五角体(5)、60个周边六角体(P)、60个中心六角体(C)、30个边缘六角体(E)和320个三联体组成,较高亮的部分表示具有差异的部分;
c、缺少VP26的重组衣壳的一个二十面体三角面被放大;
d、野生型B衣壳的一个二十面体三角面被放大;
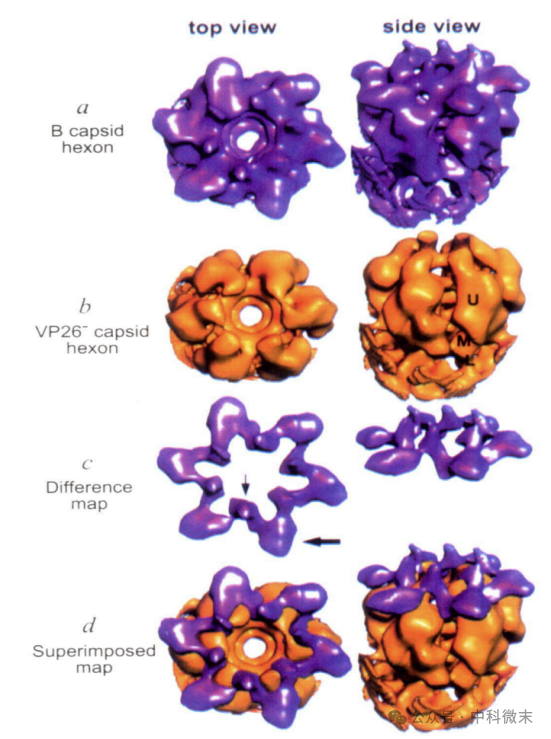
图2:P六角体从重建中计算隔离的顶视图和侧视图
a、野生型B衣壳;
b、缺少VP26蛋白的衣壳;
c、它们的差异图(代表VP26蛋白的部分);
d、差异图和VP26六角体的图像重叠显示,其中VP5用金色表示,VP26用紫色表示;
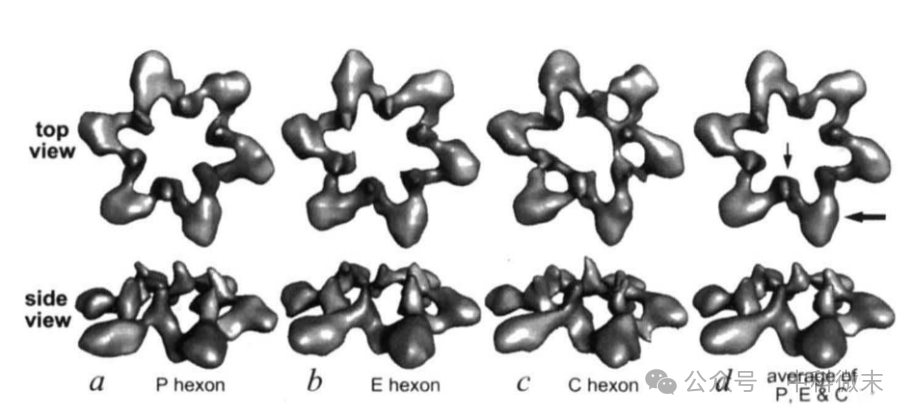
图3:类似等效VP26六聚体的比较
a-c、从B衣壳和VP26衣壳中隔离的P、C和E六角体的差异图的顶视图和侧视图;
d、从(a-c)中的差异图计算出的平均差异图,其中VP26的大域和小域分别用粗箭头和细箭头标示;
二、VP26的“装配过程”
接下来探讨了VP26蛋白在HSV-1病毒外壳中的装配问题,特别是为什么VP26只与衣壳表面的六角体部分而不是相邻的五角体部分结合。在此研究中研究者提出了三种可能的原因:
五角体和六角体的亚单位在结构上有微小的差异,可能阻止了VP26与五角体结合。
VP26在六角体中与两个相邻的VP5蛋白相互作用,而五角体的结构可能不支持这种结合方式。
VP26与六角体结合的稳定性可能依赖于蛋白质外形的六倍对称性,这种对称性在五角体中不存在。
关于VP26的装配途径,研究推测,VP26可能会先形成一个具有六倍对称性的六聚体,然后再与六角体结合。这一过程需要一些构象调整,以适应不同类型的六角体。VP26的装配稳定性可能取决于它们之间以及与VP5的相互作用。
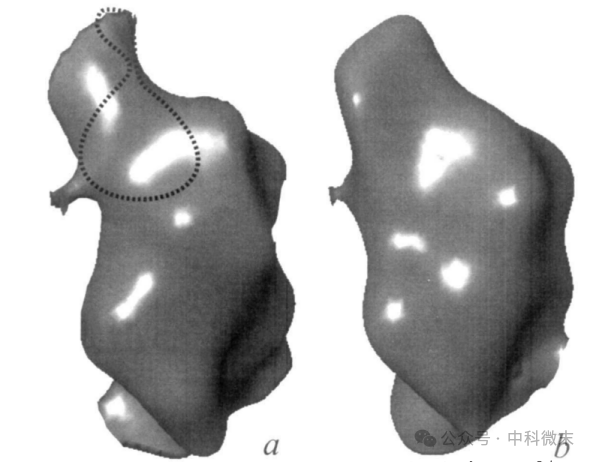
图4:从计算中隔离出的两种(六角体和五角体)衣壳亚单位上域的侧视图
a、P六角体亚单位的上域;
b、五角体亚单位的上域。两者均以与图2b中显示的P六角体亚单位相同的方向呈现;
三、VP26为什么不在五角体中?
VP26蛋白在HSV-1病毒外壳中究竟起到什么作用呢?缺少VP26的病毒外壳仍能保持结构完整,说明VP26并非外壳稳定性或组装的关键因素。所以,VP26是否对病毒的生长至关重要,以及它在病毒生命周期中的具体角色仍不明确。
研究者推测,VP26可能与病毒DNA的包装有关,但它在六角体顶端的位置似乎不支持这一功能。相反,它可能与外壳外部的蛋白质或细胞蛋白相互作用,参与病毒的运输或成熟。
研究还指出,VP26在六角体上增加了结构的刚性,而这种刚性在需要灵活性的五角体上可能是不利的。五角体可能是病毒基因组进出外壳的通道,因而需要保持一定的灵活性。正因为如此,VP26只与六角体结合,而不与五角体关联。
小结
在本研究中,研究人员使用了冷冻电子显微镜(Cryo-EM)来解析野生型和重组型HSV-1衣壳的高分辨率结构。通过比较这两种结构,使我们能够推断出VP26的组装方式及其在衣壳中的确切位置,这有助于我们理解病毒组装的分子机制。另外,VP26与VP5的相互作用对于病毒的稳定性至关重要,这一发现为未来开发抗病毒治疗提供了潜在的靶点。
在这项研究过程中,冷冻电镜发挥了巨大作用。从技术角度来看,冷冻电镜正在加深人类对病毒生命活动结构基础的理解。作为现代结构生物学技术中的中流砥柱,冷冻电子显微镜为揭示生命现象背后的奥秘作出了不可磨灭的贡献,使蛋白质的结构解析变得不那么遥不可及。中科微末团队在生物大分子及其复合体的三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
《Nature Structural & Molecular Biology》是一本专注于结构生物学和分子生物学领域的英文学术期刊,正式创刊于2004年,前身为Nature Structural Biology。该刊旨在及时、准确、全面地报道国内外结构生物学和分子生物学工作者在该领域的科学研究等工作中取得的经验、科研成果、技术革新、学术动态等。
最初,《Nature Structural Biology》于1994年作为对结构生物学领域快速发展的回应而创刊。大约十年后,即2004年,该期刊更名为《Nature Structural & Molecular Biology》。这一更名反映了该期刊内容的扩展和深化,将关注的范围从纯粹的结构生物学扩展到了包括分子生物学在内的更广泛领域。该期刊强调对生物过程中分子组件如何协同工作的功能性和机制性理解。2023年影响因子为12.5。《Nature Structural Biology》期刊与《Nature Structural & Molecular Biology》期刊之间的关系是继承和发展。
欢迎加入交流群
已开通线上互相学习分享交流平台

欢迎扫码加群,注明意图
(如:投稿、合作等)
首先非常感谢各位专家、老师、领导们关注与支持。
在此,我们开通了与大家一起在线上分享科研知识、互相学习的交流群,希望能够得到更多专业老师的指导,指正不足、分享自己的科研成果等。同时,欢迎各科研院所、医药等企业来与我们建立商务合作等。
最后,感恩遇见!感谢有您一路相伴!
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流

