
点击蓝字 关注我们

微末生物
Nanomega BioAI
前言
2024年7月,南非好望角海域的海豹群体中爆发了罕见的狂犬病疫情,这是首次记录到海洋哺乳动物中持续的狂犬病传播;2024年3月一次大规模麻疹病毒爆发发生在美国,在芝加哥一家移民庇护所导致超过60例病例;2018年8月至2020年6月,一次大规模的埃博拉病毒爆发发生在刚果民主共和国,这次疫情是历史上第二大规模的埃博拉病毒爆发,导致2,280人死亡。
这些具有高致死率的大型传播性疾病千百年来一直是人类和自然界面临的巨大挑战。而这些疾病的病原体——一类以负链RNA作为其遗传物质的病毒,往往具有高致病性,并且由于基因组是RNA而有着较高的突变率,容易快速变异达成免疫逃逸。与它们的“嚣张跋扈”大相径庭的是它们的同胞兄弟——水泡性口炎病毒(Vesicular Stomatitis Virus)。
在人类中,VSV感染较为罕见,但偶尔可以导致类似流感的症状,如发热、头痛、肌肉痛等。虽然 VSV 本身可能引发疾病,但它在医学研究和治疗开发中发挥了更加显著的重要价值。水泡性口炎病毒为何能区别于埃博拉病毒、麻疹病毒等,成为了“正派角色”?本文将带我们深度探索水泡性口炎病毒独特的原子模型及其组装机制。
正文
负链RNA病毒(NSV)包括一些最具破坏性的人类病原体,例如狂犬病病毒(RABV)(弹状病毒科)、麻疹病毒(MeV)(副粘病毒科)、流感病毒(正粘病毒科)、以及马尔堡病毒和埃博拉病毒(丝状病毒科)。水泡性口炎病毒(VSV)是一种有包膜的弹状病毒,与其他负链RNA病毒(NSV)(如流感病毒和狂犬病病毒)一样,都有三种结构蛋白:N(核衣壳蛋白)、M(基质蛋白)和 G(糖蛋白)。这些蛋白质在病毒中排列形成了独特的子弹形状。M 蛋白夹在包膜(含有 G 蛋白的膜)和核衣壳之间,核衣壳由 N 蛋白和病毒的 RNA 组成。之前的研究通过低分辨率的冷冻电镜(cryoEM)对病毒进行了初步观察,但没有明确展示 M、N 和 G 蛋白在病毒中的精确排列方式,这限制了我们对病毒组装过程的理解。在本项研究中,来自加州大学洛杉矶分校微生物学、免疫学和分子遗传学系的周正洪教授及其团队用冷冻电镜和亚粒子重建技术,首次以 3.47 Å 的分辨率清晰地看到了 VSV 病毒内部 M 和 N 蛋白的排列。他们发现,每个 N 蛋白与两个 M 蛋白紧密相连,而不是之前认为的一个。此外,通过冷冻电子断层扫描,他们还发现 G 蛋白在膜上主要呈六边形排列,有时呈五边形。N 和 M 蛋白之间的相互作用,以及 M 和 G 蛋白的匹配分布,揭示了 VSV 病毒是如何组装起来的。
VSV常被用作研究其他病毒(比如狂犬病病毒和 SARS-CoV-2)的模型。VSV 也被改造过,用来制造疫苗和抗癌药物。减毒后的 VSV 对正常人体组织没有毒性,因为它能引发强烈的抗病毒反应。基于 VSV 制造的疫苗已经开发出来,用于对抗 COVID-19、艾滋病、禽流感、麻疹、埃博拉病毒和马尔堡病毒。改造后的 VSV 还可以靶向并杀死感染艾滋病毒的细胞。因此,了解 VSV 组装的细节将有助于开发这些疫苗和治疗方法。
一、高分辨率重建揭示N与M蛋白精密配对
本研究利用了一种名为“螺旋亚颗粒重建”的创新数据计算方法,成功克服了以往在重建 VSV 病毒结构时遇到的挑战。研究人员以 3.47 Å 的高分辨率解析病毒躯干的结构,揭示了每个 N 蛋白与两个 M 蛋白配对的详细情况,并且通过达到如此高的分辨率,首次直接观察到了蛋白的氨基酸侧链和 RNA 碱基。这些发现帮助研究者构建了病毒的原子模型。通过这种新方法,他们将19个蛋白亚基(包括7个N和12个M)以及两段单链 RNA(长度分别为33和35个核苷酸)嵌入到了病毒的密度图中。在病毒的螺旋结构中,每个“非对称单元”包含一个 N 蛋白和两个 M 蛋白,这些蛋白在三个不同的层次中排列:N 层、内 M 层(IM)和外 M 层(OM)。此外还发现,在同一螺旋转中,每个 M 蛋白与两个 N 蛋白相互作用,一个来自同一非对称单元,另一个来自相邻的非对称单元。同时,RNA 分子穿过 N 蛋白之间的缝隙,每个 N 蛋白能够容纳 9 个核苷酸的 RNA。
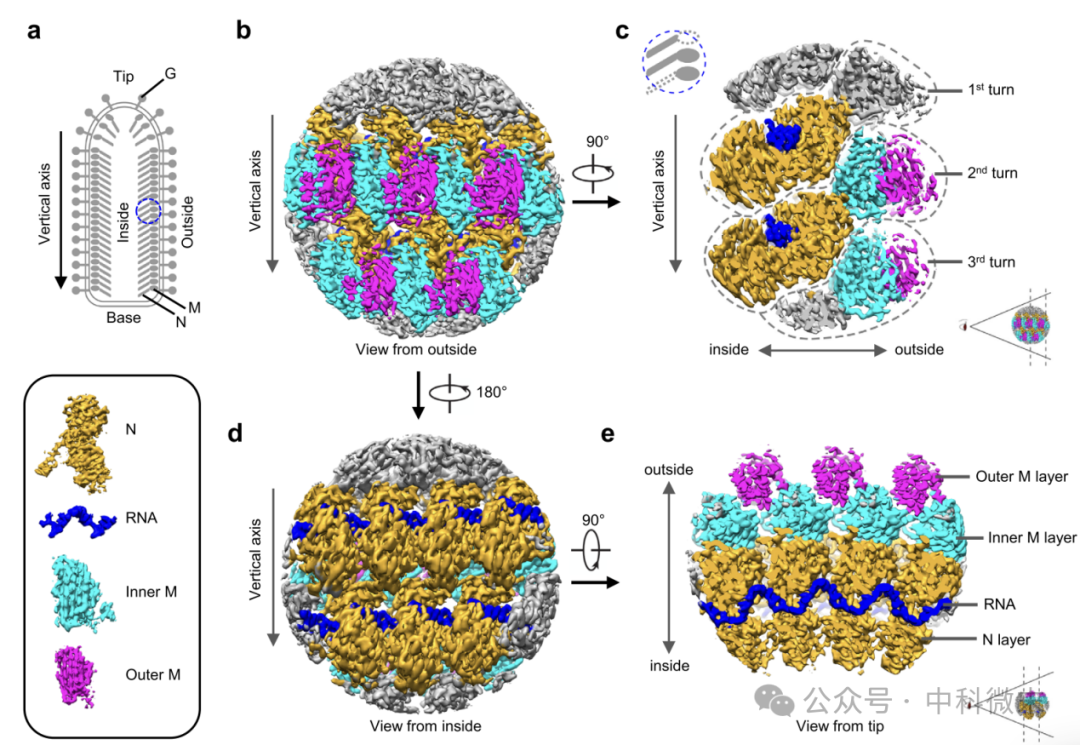
图一:近原子分辨率下VSV主干的亚粒子重建:
a VSV病毒粒子示意图。蓝色圆圈标记用于子粒子重建的区域;
b、d 部分VSV核衣壳的CryoEM密度图显示在两个相反的视图中;
c、e 从侧面和头端观察的CryoEM密度图的横截面。
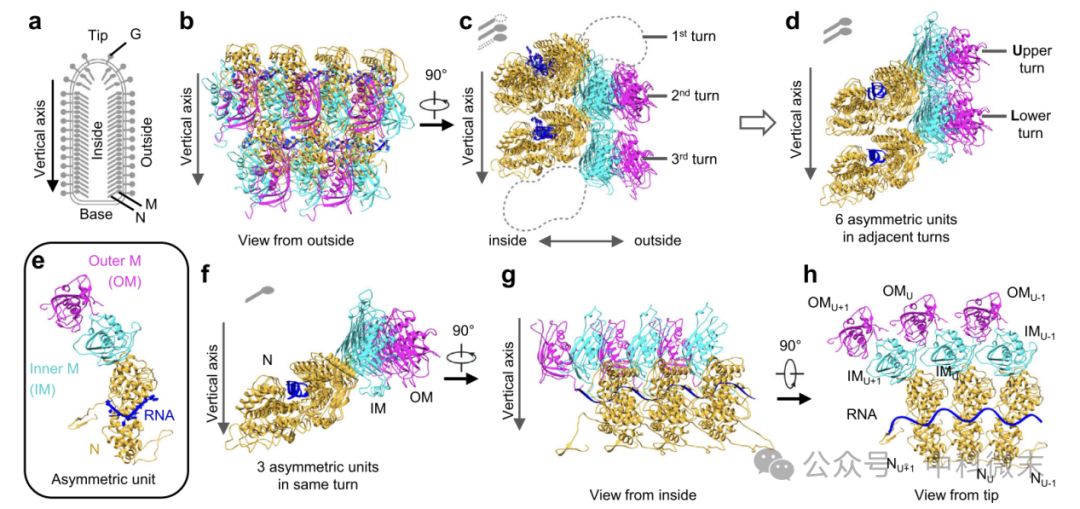
图二:部分VSV核衣壳的原子模型:
a VSV病毒粒子示意图;
b、c 原子模型的两个正交视图;
d 从(c)推导出的两圈六个非对称单位;
e 一个非对称单位,包括1个N、1个IM和1个OM以及9个RNA核苷酸;
f-h 来自同一转弯的三个非对称单元显示在三个正投影视图中。
二、N的原位结构与晶体结构的比较
研究发现,全长 N 蛋白的原位原子模型与重组表达的 N 蛋白晶体结构存在显著差异。晶体结构中的 N 蛋白每圈有 10 个亚基,而在原位结构中,每圈的亚基数量变化较大,从 35.5 到 41.5 不等。尽管原位结构和晶体结构的 N 蛋白主体和 RNA 结合方式相似,但在 N 蛋白的 N 端臂(N-arm)和 C 环(C-loop)部分存在明显差异。原位结构中的 N 臂比晶体结构中的向下旋转了 30 度,而 C 环则向外旋转了 13 度。在分析三个相邻 N 蛋白亚基的相互作用时,研究发现 N 臂和 C 环在原位结构中形成了一个稳定的“抓手”结构,这种结构将 N 蛋白亚基固定在适当的位置,并在整个螺旋转弯中保持稳定。这个“抓手”结构通过调节 N 臂和 C 环的构象,允许 N 蛋白在不同直径的螺旋中容纳不同数量的亚基。

图三 :a 单个N亚基的原位结构和晶体结构的叠加;b 从(a)延伸的三个N亚基的叠加。
三、M的原位结构与晶体结构以及IM与OM的比较
在病毒粒子中,螺旋核衣壳周围有两层 M 蛋白:内层 M(IM)和外层 M(OM)。IM 层连接了 N 层和 OM 层,但 N 层和 OM 层之间没有直接接触。横向的 IM 亚基和 OM 亚基之间的距离太大,无法形成显著的相互作用。通过将 M 蛋白的晶体结构与电子显微镜密度图匹配,研究人员发现了一些残基在原位结构中无法匹配,特别是在 IM 和 OM 层中。研究进一步显示,IM 和 OM 层在病毒粒子中的取向和构象存在显著差异,特别是在向外的区域,这些差异表明 IM 和 OM 层在病毒衣壳的组装过程中发挥了不同的作用。

图四:a 来自同一不对称单元的IM和N之间的相互作用;b IM和两个OM之间的相互作用,一个OM来自同一个不对称单元,另一个来自相邻的不对称单元;c VSV核衣壳中的亚基相互作用网络。
四、VSV病毒粒子中不同蛋白亚基之间是如何相互作用的?
VSV病毒粒子中不同蛋白亚基之间的相互作用方式可分为三种主要类型:横向、径向和垂直相互作用。
1、横向相互作用:这是指N蛋白亚基之间的相互作用,主要发生在相邻的N亚基之间。例如,Nu和Nu+1之间的相互作用,以及Nu-1和Nu+1之间的相互作用。这些横向相互作用在很大程度上决定了N蛋白的排列方式,并且通过穿过N蛋白亚基的单链RNA得到进一步增强。RNA不仅参与了病毒基因组的包装,还在维持核衣壳的稳定性和整体结构方面发挥了重要作用。
2、径向相互作用:径向相互作用由IM亚基介导,表现为IM亚基与内侧的两个N蛋白亚基和外侧的两个OM亚基之间的相互作用。这种相互作用在很大程度上维持了N和OM蛋白亚基在病毒粒子中的相对位置,确保了病毒结构的完整性。
3、垂直相互作用:垂直相互作用主要发生在IM亚基的N端部分与下方IM亚基主体之间。这种相互作用决定了病毒粒子中螺旋匝之间的间距,也就是说,它影响了病毒粒子的整体形态和结构紧凑性。
虽然这些相互作用共同决定了VSV病毒粒子的结构,但它们并不能解释G蛋白(糖蛋白)如何附着在病毒粒子上。G蛋白在病毒感染宿主细胞的过程中起着关键作用,其附着和排列方式可能与其他未知的分子机制有关。这意味着,为了全面理解VSV病毒的组装和功能,还需要进一步研究G蛋白的相互作用和附着机制。

图五:亚基之间相互作用图
五、Cryo-ET新技术揭示“G蛋白”在病毒融合中的关键角色
研究人员利用冷冻电子断层扫描技术(cryoET)对两种不同处理方式的VSV样本进行成像,一种是经过密度梯度分离的样本,另一种是未经过密度梯度分离的样本,获取了高分辨率的三维重建图像,揭示了病毒颗粒内部蛋白质的复杂排列及其功能意义。
在重建图像中,研究人员发现,N蛋白和M蛋白在病毒内部呈现出规则的排列,形成螺旋状结构,而G蛋白主要以三聚体的形式存在于病毒的包膜上。尽管两个样本都在中性pH条件下处理,G蛋白的构象却有所不同。未经过密度梯度分离的样本中,G蛋白主要处于融合前构象,这种构象下的G蛋白比融合后构象的G蛋白更加短且宽。而经过密度梯度分离的样本中,G蛋白则主要处于融合后构象。这些G蛋白三聚体在病毒包膜上排列成六边形和五边形的图案,尤其是在病毒尖端区域。
研究人员认为,这种三聚体的聚集对于病毒与宿主细胞的融合事件非常重要,多个三聚体可能共同作用,形成一个融合孔,帮助病毒膜与宿主细胞膜融合。
为了进一步分析G蛋白的结构,研究人员平均了4452个预融合G蛋白三聚体和6030个后融合G蛋白三聚体的子断层图像(sub-tomogram averaging),分别获得了15.8 Å和14.9 Å分辨率的G蛋白三聚体结构。通过比较发现,后融合构象中的G蛋白三聚体周围有三个模糊的密度团块,每个团块都与中央的G蛋白三聚体的一个亚基接触。这种模糊的密度表明这些周围的三聚体位置可能只有部分被占据。
进一步分析显示,G蛋白三聚体可以形成四种不同的超复合物,这些超复合物包含一个中心的G蛋白三聚体和不同数量的相邻三聚体,其中包含一个相邻三聚体的超复合物数量最多,占所有子断层图像的42.8%。此外,研究人员还观察到,预融合状态下G蛋白三聚体形成的六边形图案与病毒内部OM层的位置高度匹配。这表明,预融合G蛋白三聚体的内端结构可以与OM层上的位点相互作用,这种相互作用可能在病毒进入宿主细胞的过程中起到至关重要的作用。

图六:VSV G三聚体的原位结构及其六角/五边形分布
a 来自重建的断层摄影的6 μ m厚密度切片,显示未经密度梯度离心步骤纯化的代表性VSV病毒体。8.5 nm厚的糖蛋白表明,大多数G是在融合前的构象
b、c VSV G三聚体大多为融合前构象,偶尔为融合后构象。
d 病毒膜上融合前G三聚体形成的六边形瓦片的实例
e 来自重建断层图像的6 μ m厚密度切片。糖蛋白的12 nm厚度表明大多数G处于融合后构象
f、g VSV G三聚体主要为融合后构象,偶尔为融合前构象。
h 病毒膜上融合后G三聚体形成的两个连接的六边形瓦片连接到五边形瓦片。
此外,冷冻电镜下TRPV5两种结合态空间结构的对比,揭示了PI(4,5)P2结合引发的构象变化的微观细节。例如,磷酸基团与S6螺旋上的Arg584形成盐桥,导致S6螺旋延长和旋转;Trp583与Gln587相互作用,从而稳定其位置;静电作用进一步稳定diC8 PI(4,5)P2在其结合位点中的位置,这些微观变化最终导致S4-S5连接子外移、形成新相互作用、打开下门控区域等宏观结果。
六、结语
本研究中,研究人员综合运用了螺旋冷冻电子显微镜(cryoEM)和冷冻电子断层扫描(cryoET)技术,成功解析了VSV病毒中M蛋白和N蛋白的近原子分辨率结构,以及G蛋白三聚体在病毒膜上的分布情况。研究揭示了基因组RNA、N、M和G蛋白之间的分子相互作用,带来了两个重要发现:
一是N和M的比例为1:2,而不是之前认为的1:1,且N层外面包围着双层M结构;
二是G蛋白三聚体在病毒膜上以伪晶格形式排列,并与OM有弱相互作用。
此外,研究比较了VSV和麻疹病毒(MeV)中核衣壳的相互作用,发现它们的形状受N-N相互作用影响。VSV中的核衣壳由N、IM和OM三层结构组成,其稳定性不仅依赖于N亚基间的相互作用,还依赖于RNA-N、N-IM及IM-OM之间的相互作用。研究还表明,M蛋白在病毒出芽过程中起重要作用,并发现VSV中的M结构是双层的,IM和OM的外表面特性不同。OM与膜包膜有一定的相互作用,可能与G蛋白内端域相互作用,这可能与M蛋白在病毒体组装中的双重角色有关。基于这些结构数据,研究人员构建了一个完整的VSV病毒体拟原子模型,包含1235个N、IM、OM亚基、11115个RNA核苷酸、49个聚合酶以及多个G三聚体。该模型为理解VSV病毒的组装和出芽机制提供了新的视角,并展示了一种创新的螺旋结构子颗粒重建方法,具有广泛的应用潜力。
在这项研究过程中,冷冻电镜发挥了巨大作用。从技术角度来看,冷冻电镜正在加深人类对病毒生命活动结构基础的理解。作为现代结构生物学技术中的中流砥柱,冷冻电子显微镜为揭示生命现象背后的奥秘作出了不可磨灭的贡献,使蛋自质的结构解析变得不那么遥不可及。中科微末团队在生物大分子及其复合体的三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由。
欢迎加入交流群
我们开通了互相学习分享交流的平台

欢迎扫码加群,注明意图
(如:投稿、合作等)
首先非常感谢各位专家、老师、领导们关注与支持。
在此,我们开通了与大家一起分享交流的群平台,希望能够得到更多专业老师的指导,指正不足,分享自己的科研成果等。同时,欢迎各个科研院所、医药等企业来与我们建立商务合作等。
最后,感恩遇见!感谢有您一路相伴!
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流

