来源:雪球App,作者: Spica,(https://xueqiu.com/1902436484/301482155)
公司概况
Ascendis Pharma A/S(ASND)成立于2006年,总部位于丹麦哥本哈根。公司最大的亮点是拥有专利TransCon技术平台,能够设计出每周、每月、甚至半年注射一次的长效药物,显著提高患者的依从性和生活质量。目前的管线主要为3个内分泌疾病,涵盖了生长激素缺乏症、甲状旁腺功能减退症和软骨发育不全等疾病的治疗。前两者均已获批,均是可能创造10亿美元以上销售的重磅产品,后者尤其值得关注。
根据最新13F报告披露,Ascendis继续稳居RA Capital持仓第一位,占比18.23%,远高于位列第二持仓的8%。Ascendis为何持续被RA这样一线的生物医药基金青睐?
本文将聚焦近期获批治疗成人慢性甲状旁腺功能减退(Hypoparathyroidism,HP)的TransCon PTH(商品名:Yorvipath)。其实它家的长效生长激素之前更出名,之后再述。
TransCon技术平台
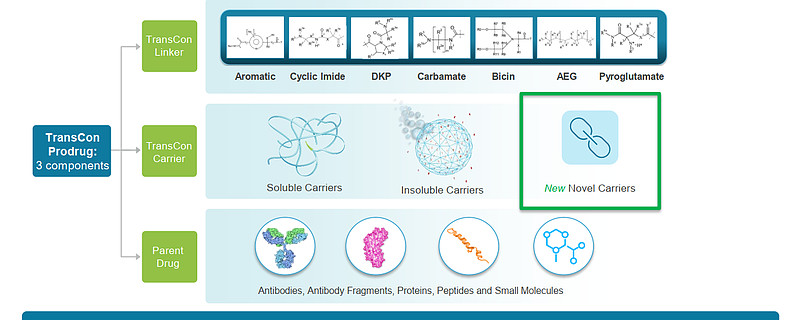
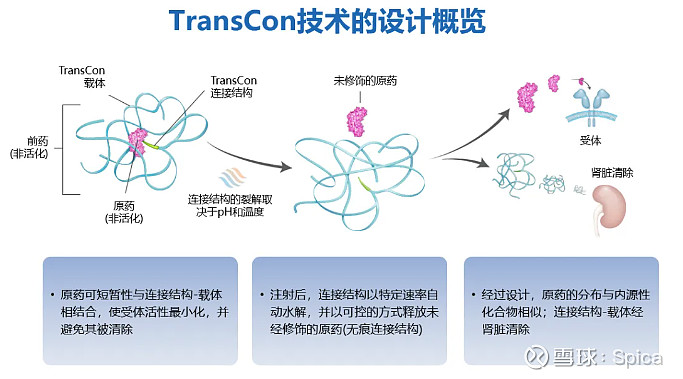
TransCon技术平台是Ascendis Pharma的核心创新技术,TransCon即“暂时连接(transient conjugation)”,能独特地将惰性载体(TransCon Carriers)与具有已知生物学性质的原药(parent drug)进行临时的(短暂的)连接。
当三部分结合后,载体分子可以使得原药以失活状态存在,并且不被人体清除。当注射至人体内后,在生理条件的pH和体温下,有活性的、未经修饰的原药将以可控的方式释放出来。由于原药是未经修饰的,因此可以维持其原有的药理机制。
许多药物药代动力学性质欠佳,在体内停留时间短,给药部位耐受性差和/或由于初始药物浓度过高而导致的全身副作用。TransCon技术结合了传统前体药物和缓释技术的优点,在疗效、安全性和给药频率方面实现了进一步优化。公司拥有一个Linker文库,可以根据不同的原药定制Linker,原药可以是蛋白、多肽和小分子,延长前药半衰期达到一周、一个月甚至半年。
TransCon Carriers分为全身系统性载体和局部载体(例如肿瘤内),这些载体通常为PEG或者一些天然或者合成的多聚合物。局部的载体可以使药物在局部高浓度的释放,从而增加药物的治疗窗口。载体部分使用了聚乙二醇(PEG),包括线性PEG、支链PEG、多臂PEG(TransCon PEG)、或TransCon Hydrogel(一种自分解水凝胶)。传统的PEG修饰技术无法实现与TransCon技术相同的控制方式释放药物。
百年磨一剑,迎来首个针对性疗法
什么是甲状旁腺功能衰退?
人体内分泌系统是一个复杂而精密的调节系统,由多个腺体和器官组成,通过分泌激素来调节和维持身体的正常功能。这些激素通过血液循环传输到全身各个部位,相互影响、调节和反馈,从而实现身体内环境的平衡。
甲状旁腺是人体内的一个小腺体,通常有四颗,分别位于甲状腺后面两侧。甲状旁腺功能减退症,是指甲状旁腺激素(Parathyroid hormone,PTH)分泌过少和(或)效应不足而引起的一组临床综合征。颈前手术是其最常见病因,大约占75%。自身免疫性疾病和遗传是甲旁减的第二大病因,可以造成孤立性HP,或者并发HP的综合征。
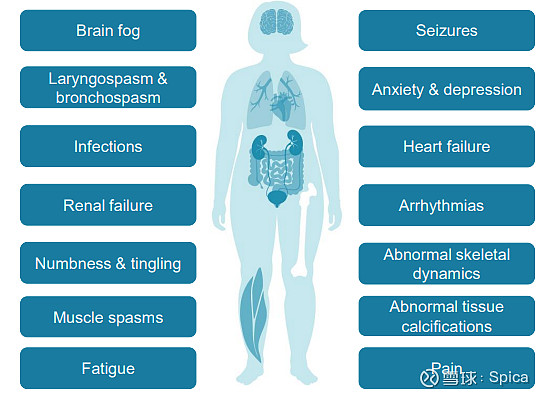
其特征是PTH水平不足,导致血液中钙含量低和磷酸盐含量升高。从短期来看,HP 能带来包括虚弱、严重的肌肉痉挛(手足搐搦)、感觉异常如刺痛、烧灼感和麻木、记忆丧失、判断力受损和头痛等一系列症状,严重影响患者的生活质量;而从长远上看,HP 患者长期高尿钙可导致肾结石、肾钙化甚至肾功能不全,长期高血磷、高钙磷乘积导致的异位钙沉积可能影响大脑、血管、眼睛等组织器官。
市场需求
美国、欧洲和日本的成人慢性甲状旁腺功能减退(Hypoparathyroidism,HP)患者约计200,000人,大多数患者由术中甲状旁腺受损或意外摘除所致。
我国亦有庞大HP患者群体。由北京大学临床研究所发起、北京协和医院牵头的一项基于760万就诊者电子健康记录的全国多中心调查研究发现:中国成人就诊者中慢性HP患病率估计为17.8/10万,女性和年轻人群患病率较高。中国成人慢性甲旁减患病率估计为5.1/10万人,与欧美报道相近,全国总患者人数保守估计也超过20万人。想必大家身边都或多或少有些亲友因各种原因做过甲状腺手术吧...
钙剂与活性维生素D在内的传统疗法仅能控制HP的症状,但要实现全身钙磷代谢的平衡调节并不容易,且由于PTH缺乏的问题没有解决,高血磷、高尿钙、骨转化异常以及由此带来的相关并发症风险依旧存在,严重影响患者的生活质量。在Yorvipath批准之前一直无恢复生理激素水平的替代治疗。
百年探索之旅
其实人类针对HP相关治疗方法已经探索百年,甲状旁腺激素(PTH)最早由Sliye于1923年发现,1929年Fuller-Albright首次在1名HP患者中使用甲状旁腺提取物。
2002年,礼来的重组人甲状旁腺激素类似物(1-34)特立帕肽(Teriparatide)获FDA批准上市治疗骨质疏松,临床上有时用于HP患者。
2015年1月,FDA批准了Natpara(rhPTH1-84)作为钙剂和维生素D的补充药物,用于控制HP患者的低钙血症。然而Natpara对尿钙排泄的控制较为短暂(10-12h),使肾结石等远期并发症风险增加,还因潜在的骨肉瘤风险被FDA贴上了黑框警告。2019年9月由于注射装置问题被FDA要求召回,武田公司宣布于今年停产Natpara。
回到今天主角Yorvipath其开发亦并非一帆风顺,反而是一路波折。

2022年8月,Ascendis凭借III期PaTHway研究、II期PaTH Forward研究和以上两项研究的开放标签扩展研究数据,向FDA递交了该药物的上市申请。
2023年5月,FDA因担心Yorvipath或设备无法保证均一的递送剂量,决定暂不批准其上市。受此负面消息影响,Ascendis股价一度超跌30%。
2024年5月,Ascendis 重新递交上市申请,附加了新的TransCon PTH的生产控制策略,但FDA再次向公司提出“重大修订”要求,Yorvipath上市再次被推迟3个月,Ascendis股价随之又下跌。(注意2年多RA Capital一路陪伴Ascendis,未因药物上市失败和推迟做丝毫减持。
 )
)
功夫不负有心人,2024年8月12日,Yorvipath终于在继2023年11月欧盟委员会(EC)批准上市后迎来了FDA的首肯,获批用于治疗成人慢性甲状旁腺功能减退(HP),成为全球首款且唯一用于治疗HP的激素替代疗法。

Yorvipath与现有在临床中曾用于治疗HP的药物对比
优异的临床数据
美国FDA批准Yorvipath是基于Yorvipath全球临床2期试验PaTH Forward和临床3期试验PaTHway的数据。在今年3月公司公布的3期临床试验共有82位慢性甲状旁腺功能减退成人患者入组,为长期用药数据。
PaTHway是一项随机、双盲、安慰剂对照3期试验,在慢性甲状旁腺功能减退症成人开展,随机比例为3:1(TransCon PTH:安慰剂)。
结果显示:第26周,高达78.7% TransCon PTH组受试者达到了主要终点,即停用传统治疗且维持血钙正常范围,而安慰剂组仅有5%(p<0.0001);
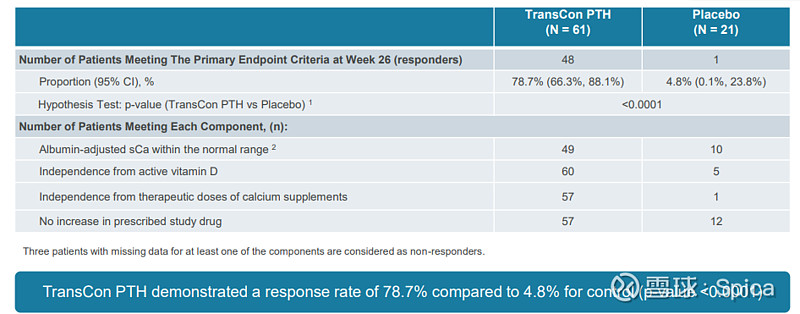
93%的TransCon PTH组受试者可停用传统治疗,随访期内TransCon PTH组平均白蛋白校正血钙水平维持在正常范围,24小时尿钙显著下降,降幅较安慰剂组更大(p=0.0085);
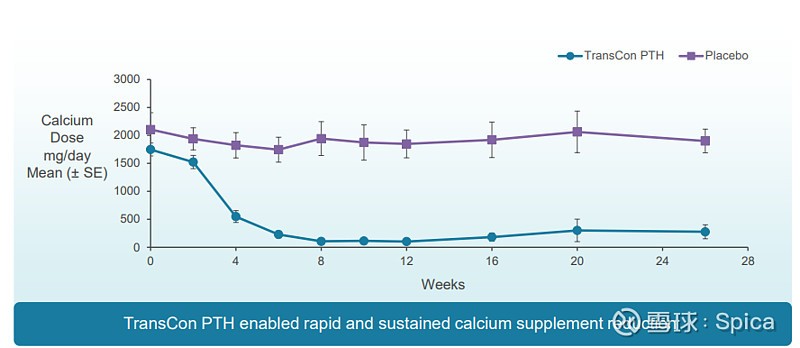
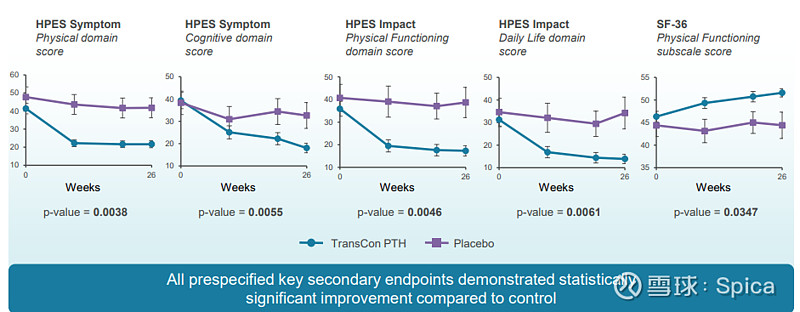
TransCon PTH组受试者在HPES疾病特异性症状、功能及幸福感方面及SF-36身体功能评分上显著改善。
安全性方面,Yorvipath耐受良好,无研究药物相关停药,其中大多数不良事件严重程度为1、2级。
市场潜力
截止2020年的数据,美国、欧洲和日本的成人慢性甲状旁腺功能减退(Hypoparathyroidism,HP)患者约计200,000人。根据临床医生的反馈大约只有30%的患者通过维生素D和钙可以得到良好控制,有20-40%的HP患者由于病情广泛或者每日服药等原因难以通过标准护理 (SOC) 进行控制,这样大约有至少4-8万HP患者需要通过激素替代疗法进行疾病管理。由于Yorvipath的定价公司尚未给出,先对标临床曾使用的Natpara,一年用药费用大约$12.3万美元,简单计算假设Yorvipath的年费用为$10万美元,最终渗透率50%(因为3年甚至5年内无竞品),Yorvipath的销售峰值将达到$20-40亿美元,妥妥一个重磅药啊!相比Ascendis截止8月中是市值不到$80亿美元,确实还有很大空间。
Ascendis正在完成商业产品的生产,并预计将在2025年第一季度开始供应;公司也计划在2024年第四季度申请FDA批准现有已生产产品的商业化,以期更早为患者提供Yorvipath治疗。公司还计划通过其美国Ascendis Signature Access Program(a.s.a.p.)为合格患者提供治疗旅程指导和财务援助。

Yorvipath注射笔(拭目以待上市)
$Ascendis Pharma(ASND)$ $诺和诺德(NVO)$ $武田制药(TAK)$

