
点击蓝字 关注我们

微末生物
Nanomega CryoAI
端粒酶是一种逆转录酶,它与非编码端粒酶RNA形成独特的核糖核蛋白(RNP)。端粒酶通常只在干细胞和生殖系细胞中有活性;当端粒缩短到临界长度,就会限制体细胞的增殖寿命。端粒酶的再激活是大多数癌细胞表型形成的必要条件,端粒酶的特定突变会导致端粒生物学的紊乱,并导致癌症。其中TERT突变频率最高,其次是TER。
往期端粒酶相关文章,点击了解~
《Science》解锁端粒酶研究新密码:从结构探秘到功能解析
TPP1是端粒DNA的六种保护蛋白(TPP1、POT1、TRF1、TRF2、RAP1和TIN2)之一(以复合物结合)。TPP1在端粒长度的调节中起着关键作用,因为它既可以招募端粒酶,也可以激活端粒酶。
由于对人类端粒酶TERT-TER催化核心和TPP1原子水平相互作用仍然不明确,为了了解端粒酶功能不全疾病的结构基础,从而开发抑制或恢复端粒酶活性的药物(治疗早衰和癌症的长期目标),加州大学洛杉矶分校化学与生物化学系Juli Feigon及Z Hong Zhou教授团队通过冷冻电镜测定了纯化的人类端粒酶与TPP1和端粒DNA的复合物,定义了端粒酶通过TPP1募集到端粒的决定因素,揭示了独特的TERT-TER相互作用。
整体结构
TPP1直接与POT1相互作用,TPP1 - POT1通过分离端粒DNA的3 '端在POT1上抑制端粒酶,当TPP1与端粒酶结合时,TPP1 - POT1转化为高度激活。TPP1寡核苷酸和寡糖结合折叠结构域(OB)通过富含谷氨酸和亮氨酸的补丁(TEL补丁)和OB结构域的N端(NOB)与TERT相互作用。POT1与TPP1结合在一个POT1结合域上,该结合域由OB域后面的连接器分隔(图1a)。
四膜虫端粒酶的高分辨率冷冻电镜结构证实p50是TPP1激活功能的同源物,可以结合TEN和TRAP。然而,TPP1仅以细胞周期依赖的方式与人类端粒酶短暂相互作用,这增加了结构研究的挑战性。
研究者将DNA结合端粒酶纯化后与大约十倍过量的TPP1 OB结构域(以下简称TPP1)孵育(图1a),然后在冷冻电镜网格上玻璃化。端粒酶具有两部分结构,催化核心RNP(图1b-d)和H/ACA盒子 RNP(图1f,g)由TER的P1a和P4.1-P4.2-P5区域连接(图1e)。
对两种RNP分别进行聚焦细化,TERT-TER催化核心的分辨率为3.3-3.8 Å, H/ACA RNP的分辨率为3.2 Å(图1b,c, f)。端粒酶H/ACA RNP包括两组完整的H/ACA蛋白dyskerin, H/ACA RNP包括两套完整的H/ACA蛋白dyskerin, GAR1, NOP10和NHP2分别结合到连续的不规则茎环(P4和P7)上,后面分别是box H (AGAGGAA)和box ACA核苷酸,以及一个单独的TCAB1与dyskerin和NHP2结合在P8顶端环上(图1e-g)。催化核心包括TERT和TER模板-假结(t/PK)和保守区4-5 (CR4/5)。TERT的保守RNA结合域(RBD)、逆转录酶(RT)和C端延伸(CTE)形成一个环,TERT特有的TEN和TRAP 在TERT环上方形成一个复合物。TPP1结合TERT TEN和TRAP(图1a,c,d)。CR4/5从P4延伸,P5,P6和P6.1通过三向结连接(图1e)。
在此研究中催化核心的整体分辨率更高,能够更准确地将序列分配给cryo-EM密度和侧链位置(图1d)。
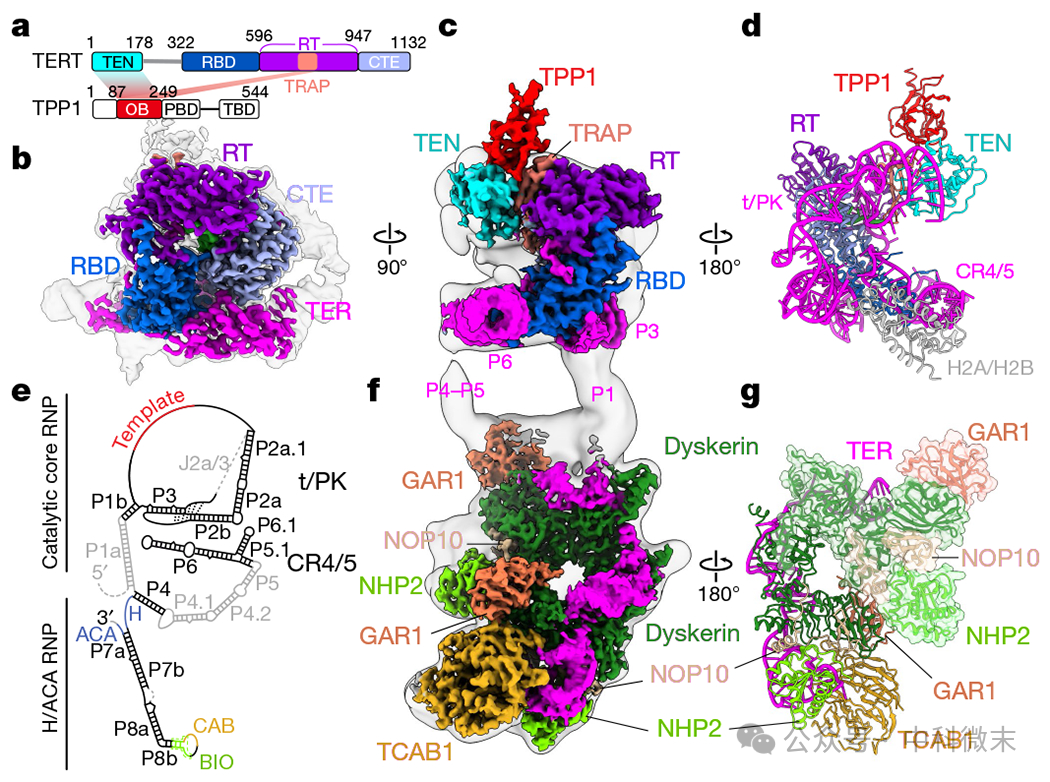
图1 人类端粒酶与TPP1的结构
TPP1与TEN-TRAP的相互作用
不含TPP1和含TPP1催化核结构的一个显著区别是,TEN在含TPP1的配合物中具有更高的分辨率(图2a)。
人类TEN和TRAP的整体结构,以及TEN和TRAP之间延伸的β-片,与四膜虫端粒酶非常相似(图2b)。然而,TEN - trap相对于TERT环的位置不同,这可能是由于人类端粒酶中与TEN相邻的假结(P2a.1)的双链末端造成的。TRAP的N端和C端分别通过柔性连接器连接到保守螺旋IFDa和IFDc,从而允许TEN-TRAP相对于TERT环的位置动力学(图2b)。
TPP1-TEN-TRAP在四膜虫p50-TEN-TRAP10上的叠加表明,结合界面在整体上是相同的,包括它们的三向相互作用,但大多数特定的相互作用并不保守。TPP1和TEN-TRAP之间存在连续的界面(图2e), TRAP上包括与先前确定为TEL patch24和NOB27的残基的相互作用(图2c)。
研究者确定了三种电荷的相互作用,TEN K78-TPP1 E215,TRAP R774-TPP1 E168 (TEL补丁)和TEN D129-TPP1 R92 (NOB)(图2d)。界面的其余部分主要是疏水的,主要包括TRAP和TPP1上的亮氨酸(图2f)和TEN上的短侧链(丙氨酸、甘氨酸和丝氨酸)(图2e)。其中TERT突变R774L和Y772C分别与先天性角化不良和再生障碍性贫血相关。
研究者使用端粒酶直接活性测定法测试了TEN-TRAP界面残基上的丙氨酸取代,以评估它们在TPP1结合中的重要性。所有突变体都显示出这种活性刺激显著降低,约50-85%,包括K78A34(降低75%)(图2g)。
接下来,研究者测试了TPP1结合缺陷是否会影响TPP1 - pot1对RAP的增强,发现添加TPP1-POT1对活性影响不大,但RAP提高了约1.4倍。TEN-TRAP残基替换导致TPP1 - pot1对RAP的刺激降低的模式与单独使用TPP1对RAP活性的刺激降低的模式相似(图2g)。
这些结果验证了TPP1结合的界面相互作用。这种结合TPP1的TEN-TRAP界面原子模型明确了端粒酶募集的结构要求,为通过抑制募集来抑制端粒酶作用的药物设计提供了合理依据。
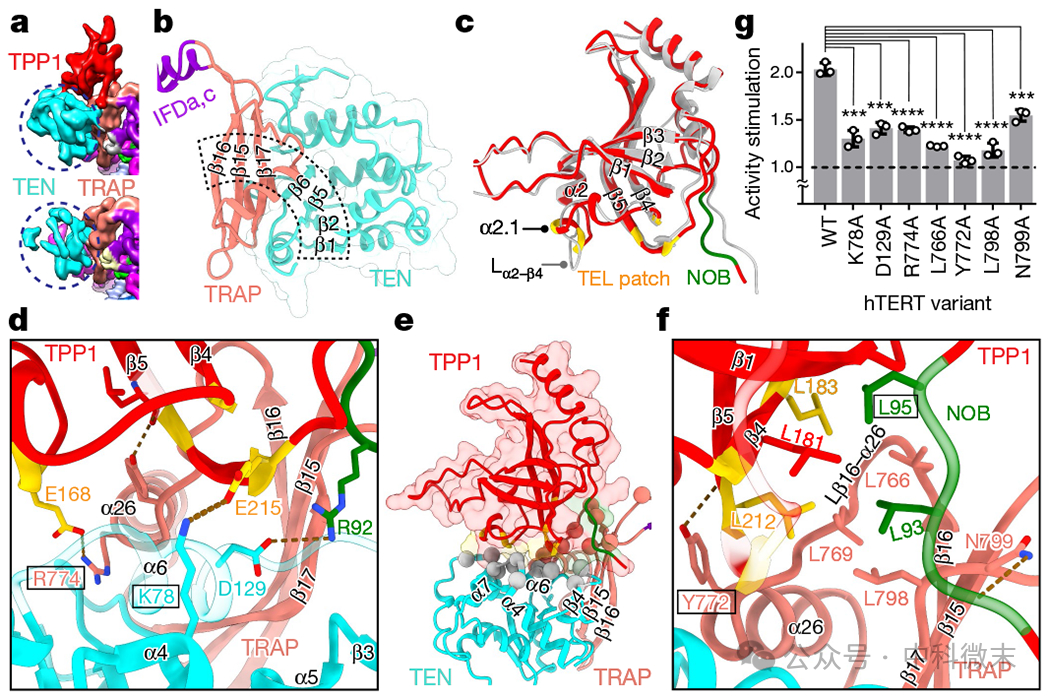
图2 TPP1与TERT TEN-TRAP的相互作用
催化腔的特征
TER t/PK在TERT环周围形成一个椭圆形,TERT环被P1b封闭(图3a, b)。t/PK的单链区域包括模板沿着RBD (5 '), RT(模板)和CTE(3 ')包裹,在那里通过TRAP-TEN(图3a)。在该结构中,只有DNA引物d(T12TTAGGG)的最后四个碱基与模板配对,双工移出了活性位点(图3b)。这一观察结果与端粒重复合成的多个步骤中四膜虫端粒酶结构中的4个碱基对(如果活性位点被占据,则为5个碱基对)的双工结构一致,表明短而不稳定的双工结构是端粒酶的共同特征。
在端粒重复合成过程中,模板移动边界由模板边界元(template boundary element,TBE)在其5 '侧起锚定作用。垂直定位的P1b-P3通过与单核苷酸连接(C186)和两侧碱基对的相互作用锚定在TERT RBD上(图3c)。这证实了P1b-P3是TBE,与诱变结果一致。模板通过8个核苷酸的连接体(TBEL)连接到TBE上,而在四膜端粒酶中只有2个核苷酸(图3b)。尽管残基U38至U43被松散地捆绑在一起, G44和U45被插入RBD上的结合口袋中,这似乎是一个次级“边缘”锚点(图3a)。随着模板的移动,口袋中的核苷酸可以弹出并依次被后续残基取代,直到TBEL完全拉伸时的U41-U42。边缘锚点有助于将模板正确地定位在催化腔中。
模板- DNA双链通过模板与RT上的基序3和手指的相互作用以及DNA与CTE上的拇指环、拇指螺旋和RBD8上的T基序的相互作用保持在催化腔中(图3d, e)。首先在四膜虫端粒酶中被发现RBD上的一个桥环,桥接双链的两端和它的保守尖端残基插入到主槽侧(图3d, e)。将这些残基单独替换为四膜虫中的对应残基对活性影响很小,而用丙氨酸替换则大大降低了活性和RAP。
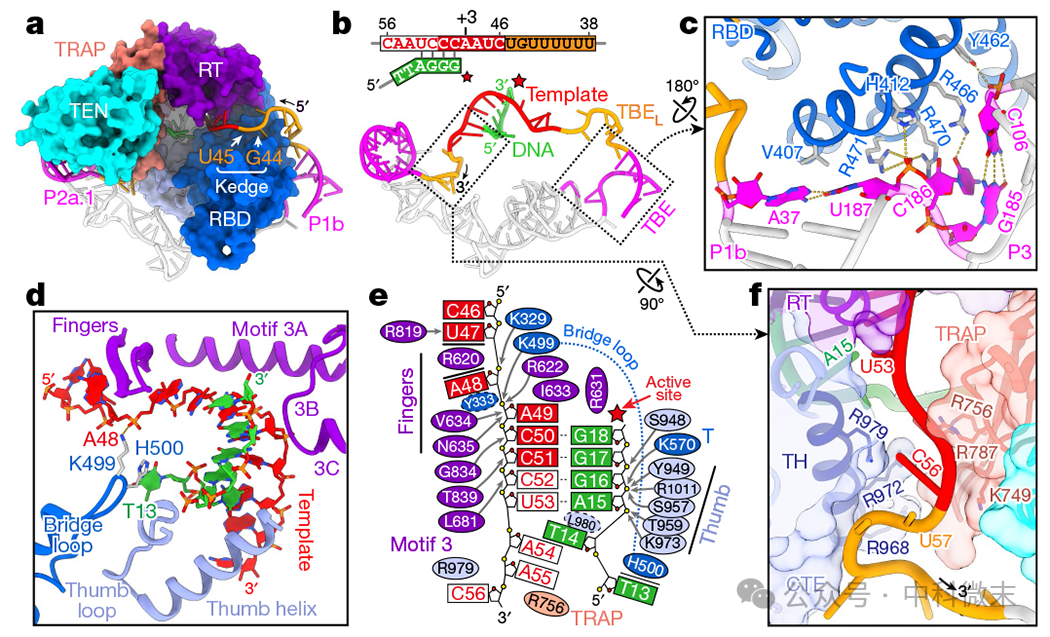
图3 TERT与模板- DNA双工的相互作用
K499与Y333、E565 (T基序)和R622(指基序)形成一个保守的相互作用网络,调节模板碱基逐步翻转到活性位点。在双链的另一端,第一个未配对的DNA核苷酸(dT14)插入到双链-单链连接处的模板核苷酸之间,并与L980相互作用(图3e)。相比之下,在四膜端粒酶中,所有未配对的DNA核苷酸从桥环连续堆叠在F414下。
这种差异可能是由于在没有端粒DNA处理蛋白POT1的情况下,存在DNA的灵活性,而在四膜虫中,端粒DNA处理蛋白POT1与组成性组装的同源物Teb1不同。
在模板3 '侧,模板对准区进入TRAP和CTE拇指螺旋(TRAP-TH通道)之间的窄带正电通道,模板和P2a.1之间的单链RNA在下面的CTE上做一个鹅颈转弯(图3f)。在端粒重复合成过程中,排列在通道内的精氨酸可以作为模板运动的棘轮,正如四膜虫端粒酶。TPP1结合抑制了TEN-TRAP的动力学,研究者认为这有助于形成最佳的TRAP-TH通道来调节端粒DNA合成。
总的来说,人类端粒酶催化腔与四膜虫的共同特征表明,重复合成和易位的机制在很大程度上是保守的。
TERT-TER相互作用支撑催化核心
在模板的3 '侧,结构保守的假结形成一个不规则的螺旋,环绕着从CTE到RBD的TERT环(图4a, b)。
假结可分为三个区域:
P2a.1,连接到模板的单链3 ' ;
P2a-P2b,包含5个核苷酸(nt)不对称内环(J2a/b);
P2b-P3包含环干相互作用的保守碱基三元组;
伪结与TERT环的相互作用主要位于P3上,它适合CTE和RBD之间带正电的间隙(图4a)。除了P2a.1-P2a和C116在P2b-P3交界处之间的G73,整个P2仅在其5 '端接触TERT,其中P2a.1在其主槽侧紧挨着TEN带正电的表面(图4b)。尽管P2b-P3固定在TERT上,但假结的其余部分表现出构象动力学,通过对不同类别平均的建模揭示。
除了P3的相互作用外,TERT环还与CR4/5从另一侧结合进一步稳定。在CR4/5中,P6堆叠在p5.1上,P6.1发夹垂直于P6(图4c)。高度保守的P6.1发夹连接RBD和CTE,而P6结合RBD(图4c)。CR4/5和假结共同形成一个框架,抑制TERT环中大规模的构象变化(图4b)。
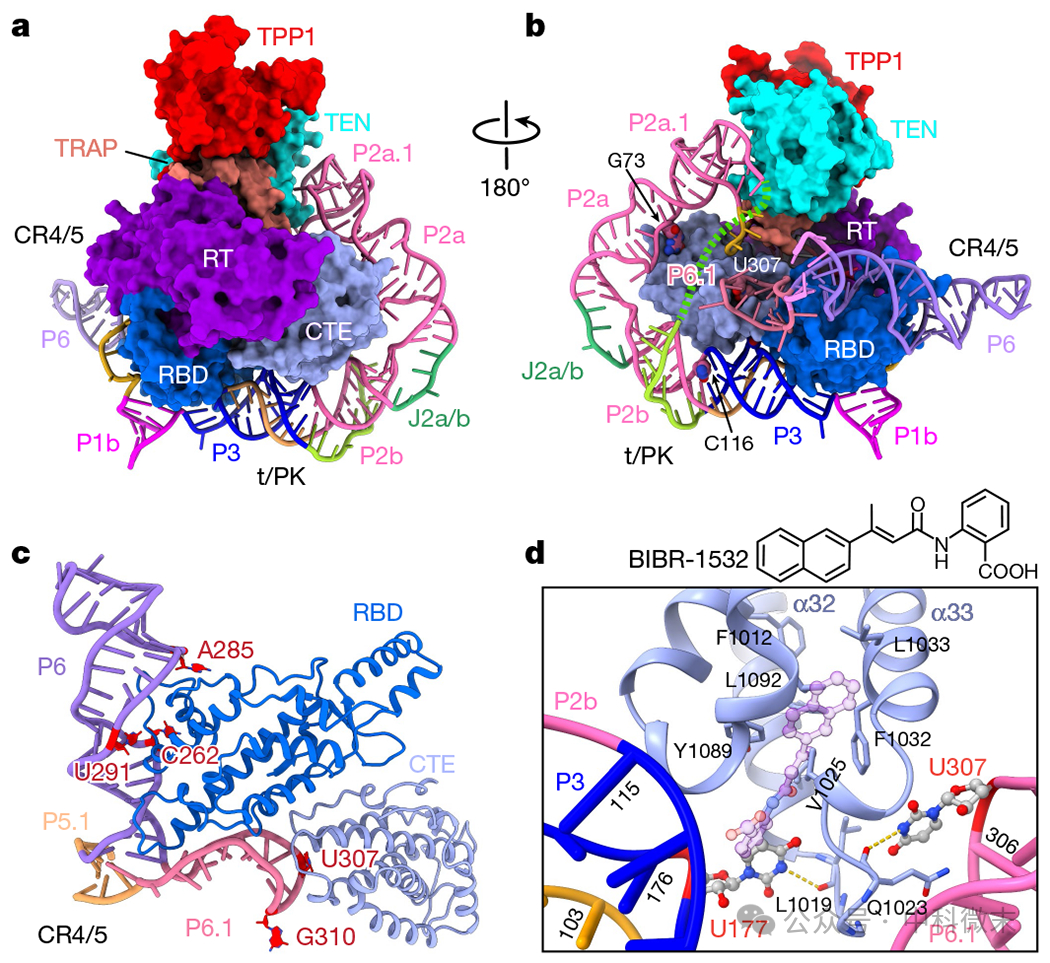
图4 TERT和TER之间的相互作用
在P2b-P3中的三个U-A-U三联体下面的单个凸起核苷酸(U177)位于CR4/5中P6.1发夹环上的U307的约7 Ç范围内(图4d)。模型显示这两个核苷酸结合在CTE两侧的独立口袋中,由环Lα32-α33(氨基酸1019-1028)分开。
疾病突变 L1019F(肺纤维化)、V1025F和V1090M(再生障碍性贫血)和N1028H (DKC)会破坏稳定P2b-P3和/或P6.1与CTE结合的相互作用。
端粒酶特异性抑制剂BIBR1532基于与Tribolium TERT样蛋白的CTE同源性对接到其在CTE上的结合位点,发现其苯甲酸环会阻断U177的结合,其萘基团会重新定位Lα32-α33,这也会影响P6.1相互作用(图4d)。
因此,作为一种非核苷端粒酶抑制剂,BIBR1532破坏TERT-TER的关键相互作用,使其成为已知的第一个靶向TER非模板区域的药物。
对催化核心疾病突变的见解
TERT和TER分别有185个和75个以上的突变导致端粒缩短,表现为端粒酶不足的疾病。在TER中,它们绝大多数在假结和CR4/5中,只有少数在H/ACA RNA13中。将已知的TER和TERT的疾病相关突变映射到该结构上(图5)。
几乎所有的TER突变都在催化核心接触或毗邻核苷酸接触TERT。值得注意的是,假结P3和P1b中有许多突变(图5)。其他一些突变会通过破坏茎碱基对影响关键折叠,如J2a/b环中的保守90°弯曲44。催化核心的3.3 Å模型揭示了特定的TERT-TER接触会受到个体突变的影响(图5)。
肺纤维化的例子包括TERT RT指(R622C)和TRAP (R756L)基序的突变,这些基序会破坏与模板的相互作用。R622是保守残基网络的一部分,它调节模板核苷酸在活性位点对面的顺序翻转(图3e)。R756位于TRAP-TH通道的顶部,在那里它与模板(A55)堆叠,并帮助调节核苷酸添加过程中模板的单向运动(图3f)。
先天性角化不良症的TER突变包括G73U;G73是P2a的单一残基,与CTE特异性相互作用的1-J2a /b结(图4b)。先天性角化异常R381P (RBD)会破坏精氨酸与CR4/5螺旋P6中凸起的U291侧三个碱基对的相互作用。
与TERT直接接触或稳定延伸的P3干的整个假结P3突变与再生障碍性贫血和其他疾病有关。再生障碍性贫血TER突变G305U会破坏P6.1的顶部并与CTE Q1023相互作用,而TH R979Y会影响TRAP-TH通道中的模板处理(图5)。
急性髓性白血病G309U (P6.1)和骨髓增生异常综合征R535H (RBD)突变分别可能导致破坏P6.1 - tert与CTE Q1023和P6.1 A302的相互作用。最后,K570N(位于RBD T基序中)与Hoyeraal-Hreidarsson综合征(图5)和肺纤维化有关;K570在模板- DNA双链中与DNA主干相互作用(图3e)。
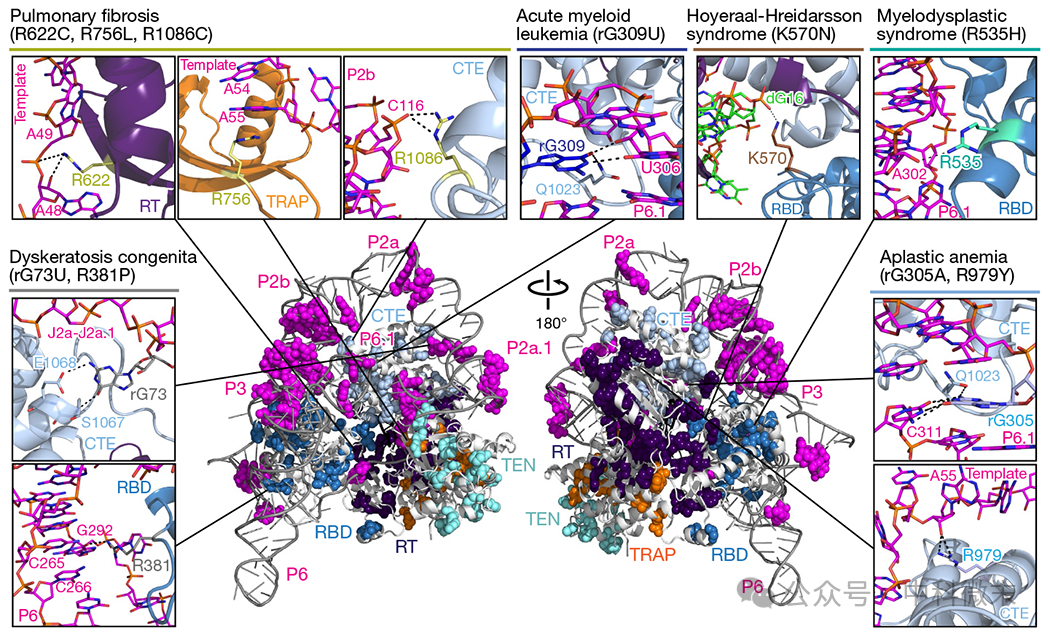
图5 人类TERT和TER的疾病相关突变
对这些相互作用的分析验证了TERT-TER相互作用对端粒酶活性的重要性,并为药物靶向提供了结构基础。
总结
在此研究中,研究者通过冷冻电镜探究了人类端粒酶与庇护蛋白TPP1复合物的结构,阐明了招募和激活所必需的详细界面。并在3.3 Å分辨率下比较了四膜虫和人类端粒酶催化核的共同和不同特征,揭示了端粒重复添加过程中模板DNA处理、模板边界定义和双工长度的细节。
TPP1结合稳定了TRAP-TEN界面和TRAP-TH通道,其与POT1的结合使其能够结合新合成的端粒DNA。对疾病突变以及端粒酶特异性抑制剂BIBR153211、12的结合位点的分析揭示了TERT-TER相互作用对端粒酶活性和作为潜在药物靶点的重要性。
这些发现为结构导向的端粒酶靶向药物的发现和对导致端粒生物学紊乱的疾病突变的更深入理解提供了基础。鑫研微末团队依托自主研发的冷冻电镜技术,专注提供结构生物学研究服务,实现目标蛋白原子级高分辨率的结构解析。鑫研微末团队在冷冻电镜技术方面积累了大量算法与专利,可提供“高难度结构解析有解决方案,低难度结构解析更迅速、价格更优惠”的技术服务。展望未来,鑫研微末将继续致力于冷冻电镜技术的研发和创新,持续推出更多切合客户需求的结构解析解决方案。
微末生物
Nanomega CyroAI
欢迎加入公司冷冻电镜技术讨论群 一起讨论
添加公司客服马老师微信,备注“加群”
期待与您交流!

#端粒酶功能不全性疾病 # Cryo-EM #蛋白质 #多蛋白复合物 #端粒酶
美国加州大学洛杉矶分校化学与生物化学系Baocheng Liu 为本文第一作者,
Z Hong Zhou , Juli Feigon为共同通讯作者。
原文链接:
https://www.nature.com/articles/s41586-022-04582-8
点击“阅读原文”,查看文章↓
如果您对特定研究领域感兴趣,欢迎通过微信公众号搜索 “Cryo-EM”、“膜蛋白”、“纳米颗粒”等关键词,查阅我们过往发布的相关文章。
您还可以添加我们的研究助理,以便进行更详细和具体的咨询。我们将竭诚为您提供帮助。
内容中包含的图片若涉及版权问题,请及时与我们联系删除

