
点击蓝字 关注我们

微末生物
Nanomega CryoAI
Ca2+调节多种细胞内活动,如基因转录、细胞运动、肌肉收缩和感觉转导。TRPV亚家族中的6个成员(TRPV1-6)都是必需的Ca2+渗透通道。其中TRPV2主要定位于细胞内膜,其功能原理尚未得到研究。在胚胎DRG神经元和其他神经元细胞系中,内源性TRPV2在体细胞和轴突内呈点状分布,并与Rab7(一种晚期内体标记物)结合,促进神经营养因子信号传导下游的神经元生长。然而,TRPV2和其他TRPV通道受到何种生理调节仍然未知。有研究表明,翻译后修饰、脂质-蛋白相互作用和蛋白-蛋白相互作用可能调节这些通道的功能。为了更深入的了解TRPV2的细胞功能,凯斯西储大学医学院药学系 Vera Y Moiseenkova-Bell 及其团队与加州大学洛杉矶分校的周正洪教授团队合作,通过低温电镜单粒子重建(cryo-EM)技术在~ 5 Å分辨率下确定了大鼠TRPV2全长的结构,这些结果进一步加深了对TRPV通道亚族的多种功能调控的理解。
TRPV2的全结构冷冻电镜重构
基于低温电镜图谱,研究者使用先前发表的TRPV1原子模型5、6作为同源模型,为所有跨膜(TM)螺旋(S1-S6)、孔螺旋、选择性过滤器、N端连接器和通道的一部分C端建立模型(图1)。清楚地解析了锚蛋白重复结构域(ARD)的所有6个n端锚蛋白重复,表明ARD在TRPV2全长中是一个刚性的、稳定的结构域(图1)。但在低温电镜图中,N端(Met 1-Asp 73)、S1-S2连接体(Ile 422-Gly 430)、孔转塔(Glu 561-Leu 594)和C端(Glu 716-Pro 761)的前73个残基的密度并不明显(图1a),表明这些区域是灵活或无序的。
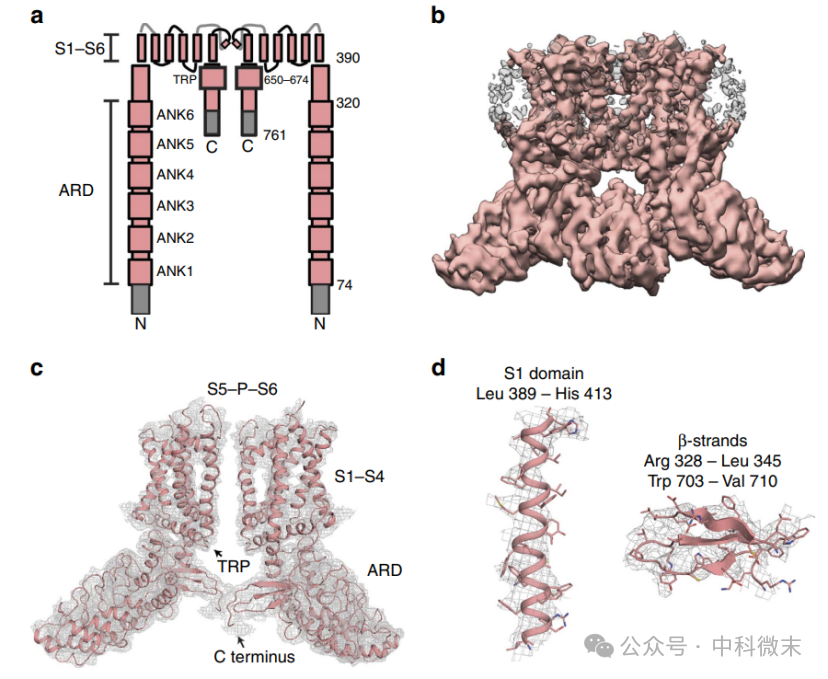
图1:TRPV2全长的单粒子冷冻电镜分析
TRPV2全长的孔隙结构
apo-TRPV2的总体结构与其他TRP通道的结构相似,也与电压门控通道和配体门控通道相似。TRPV2的2D类平均和最终的3D重建图明确显示了与TRPV1类似的四聚体组装。与TRPV1和TRPA1一样,apo-TRPV2的孔由两个缩窄或门组成:上部门位于通道外部孔区域的选择性过滤器处,下部门由S6的远端组成(图2a)。对apo-TRPV2孔域进行更详细的结构分析,意外地发现,在没有配体(apo-TRPV1)的情况下,上缩孔和下缩孔比TRPV1的同源位点(Gly 643和Ile 679)更宽,在上缩孔和下缩孔处分别测量Cα-Cα的距离为12.4 Å和16.1 Å(图2a)。apo-TRPV1的结构被认为包括上下两个门都关闭的状态(图2b),而在激动剂树脂化毒素(RTX)和双结毒素(RTX/ DkTx-TRPV1)存在时,两个门都打开(图2d)。此外,在辣椒素存在下,TRPV1的结构包括一个关闭的上通道和部分打开的下通道(图2c),可能代表通道的中间构象apo-TRPV2的上通道比TRPV1关闭的上通道宽。此外,apo-TRPV2的下栅极在所有状态下都比TRPV1的Cα-Cα距离更大,包括RTX/ DkTx-TRPV1的下栅极打开(14.4 Å;图2)。这些结果表明,TRPV2通道可以容纳部分水合的Ca2+、Na+和K+离子,以及载脂蛋白态的大型有机阳离子。
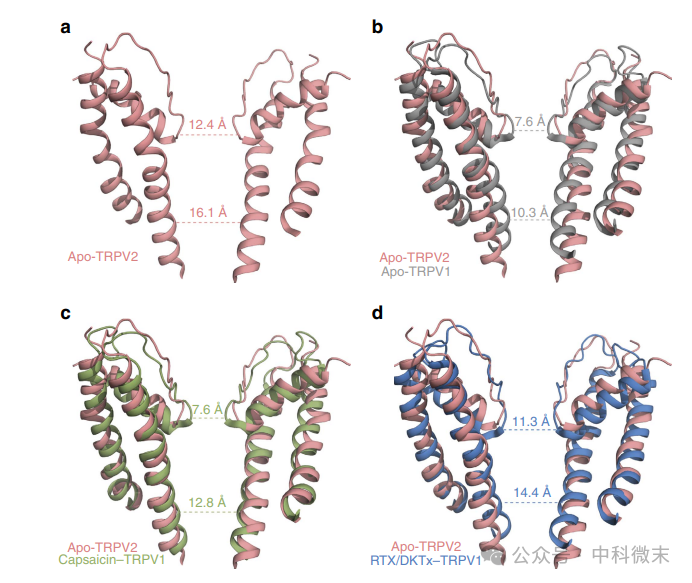
图2:TRPV2离子渗透途径分析,不同颜色表示不同状态下通道对离子渗透的结构
全长TRPV2中ARD和孔螺旋的位置
基于TRPV1封闭和开放结构的分子动力学模拟预测,通道的打开是由细胞内ARDs的一系列构象变化引起的,随后是上门和下门的变构变化,包括相对于细胞内结构域的孔域的四级扭曲。因此,我研究者将apo-TRPV2的ARD与apo-TRPV1和RTX/ DkTx-TRPV1的位置进行了比较,以进一步了解apo-TRPV2的结构(图3a)。
在apo-TRPV1和RTX/ DkTx-TRPV1之间,ARD明显向上移动(图3a)。比较显示,apo-TRPV2 ARD的位置介于apo-TRPV1和RTX/ DkTx-TRPV1之间(图3a)。此外,比较了apo-TRPV2的孔螺旋相对于通道中轴线的位置,因为已经提出RTX/ DkTx-TRPV1结构中孔螺旋的扭曲有助于打开上层闸门(图3b)。RTX/ DkTx-TRPV1的孔螺旋相对于apo-TRPV1呈顺时针扭转(图3b),而apo-TRPV2的孔螺旋位置再次落在apo-TRPV1和RTX/ DkTx-TRPV1之间(图3b)。此外,apo-TRPV2 S5螺旋的位置与RTX/ DkTx-TRPV1相似(图3b)。这些结果表明,在apo-TRPV2通道的低温电镜结构中,ARDs和孔螺旋的位置与apo-TRPV1和RTX/ DkTx-TRPV1不同。
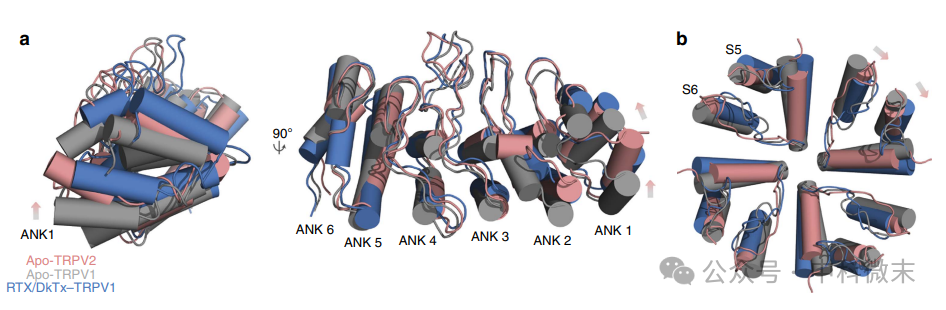
图3:TRPV2和TRPV1的锚蛋白重复结构域和外孔区比较
全长TRPV2外孔区散度
TRPV1和TRPV2在S5、S6、孔螺旋和选择性过滤器(Gly-Met-Gly-Asp /Glu)中具有高序列同一性。尽管如此,TRPV1和TRPV2是非选择性阳离子通道,具有不同的Ca2+选择性(TRPV1的PCa2+/PNa+=10, TRPV2的PCa2+/PNa+=3)。在apo-TRPV1和apo-TRPV2之间观察到的外孔区域上栅极的结构差异(图2)可能解释了两个通道之间阳离子选择性的差异。在此研究中观察到的载脂蛋白trpv1和载脂蛋白trpv2的孔隙结构差异可能是由于这两种蛋白之间固有的结构差异所致。相反,在纯化过程中,蛋白质的TM结构域以不同的方式稳定。可能是洗涤用的生化制剂差异使得采样不同的构象状态,从而导致了观察通道结构的差异。
也有可能是稳定“最小亚基”TRPV1所需的截断导致了TRPV1结构的孔隙结构的改变。具体来说,连接S5与孔螺旋的约30个氨基酸环,称为孔转塔(图4a),与通道门控、大有机阳离子渗透和孔扩张有关。TRPV1孔转塔内的关键残基(Gly 618和Ser 629)突变,这些残基在TRPV2 (Gly 582和Ser 592;图4a),改变了TRPV1对大阳离子的渗透性,表明孔转塔有助于上部闸门的膨胀。冷冻电镜研究中稳定TRPV1需要删除孔隙转塔区域,而研究者采用全长TRPV2,其中转塔区域是完整的,尽管因其灵活性而分辨率较差。同源性模型预测,TRPV1结构中转塔区域的缺失会改变孔隙结构,可能解释了TRPV1和TRPV2之间观察到的一些孔隙结构差异(图2)。TRPV2 (TRPV2 Δ564-589)中孔隙转塔结构域的截断与TRPV1的“最小亚基”位点相当(图4a)对蛋白表达(图4b)、定位(图4c)和细胞表面水平(图4d)几乎没有影响。然而,与表达TRPV2 WT的细胞相比,TRPV2 Δ564-589的表达减弱了Ca2+对2-APB(一种外源TRPV2激活剂)的响应(图4e)。
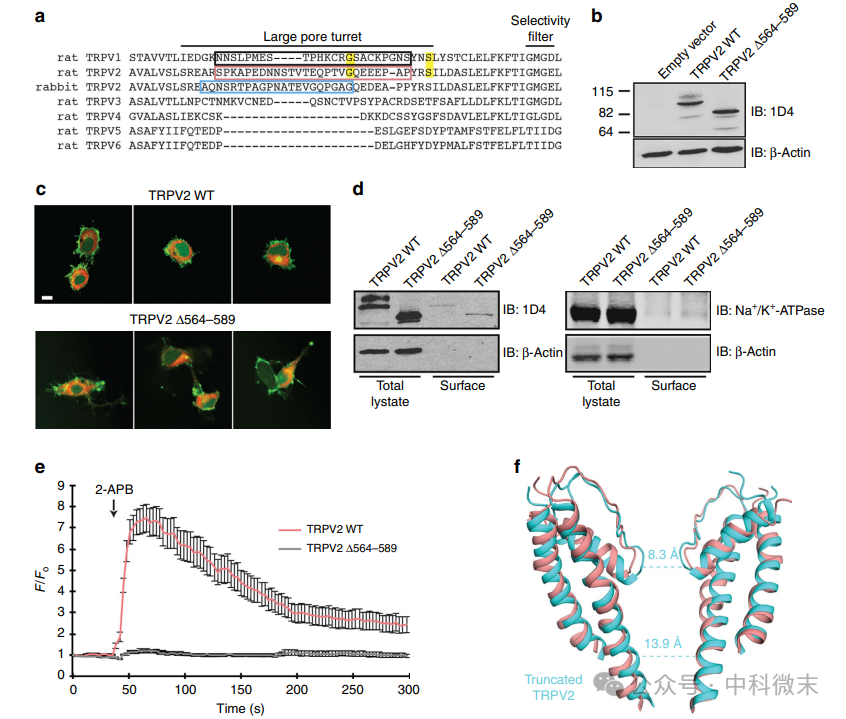
图4:大孔转塔可能影响TRPV2离子渗透途径
除了在N和C端截断外,用于冷冻电镜分析的兔TRPV2结构也缺乏孔转塔结构域(图4a)。截断的兔TRPV2的外孔区域与“最小”的大鼠apo-TRPV1的构象相似,由于通道截断和生化方法的相似性,在冷冻电镜密度和原子模型中,截断的兔TRPV2和大鼠TRPV2全长的整体结构差异都很明显。对截断的兔TRPV2和大鼠TRPV2全长的孔隙区域进行比较发现大鼠TRPV2,全长具有更宽的上下门(图4f)。与Ca2+的结果相反,截断大鼠TRPV2的孔转塔会降低通道对2-APB的响应(图4e)2-APB对TRPV2的激活是物种依赖性的,因此,大鼠TRPV2对2-APB的反应可能与兔TRPV2有本质的不同。
TRPV2全长结构中的脂质结合位点
膜脂是已知的TRPV通道功能的调节剂。截断的兔TRPV2在脂质/胆固醇半琥珀酸盐存在下纯化,胆固醇分子的密度占据了TRP结构域上方S1-S4螺旋束形成的缝隙。此外,在apo-TRPV1和RTX/ DkTx-TRPV1中也观察到可能代表脂质分子的弱密度。基于这些观察结果,研究者认为脂质结合在通道的这个区域可能在功能的调节中起作用。与apo-TRPV1和RTX/ DkTx-TRPV1相似区域的密度可能代表与大鼠TRPV2全长共纯化的脂质分子。
在截断的兔TRPV2中观察到另一种可能的脂质密度,在S4、S4 - s5连接体和相邻亚基的S6之间,位于RTX/ DkTx-TRPV1结构中与RTX分子相似的位置。此外,在apo-TRPV1结构中也观察到弱脂质密度。全长大鼠TRPV2中相邻亚基的S4螺旋、S4 - s5连接体和S6的位置与截断的兔TRPV2中的位置不同。在全长TRPV2中,S4螺旋的构象与apo-TRPV1类似,而截断的兔TRPV2的S4螺旋更倾向于RTX/ DkTx-TRPV1的位置。这种观察到的结构差异表明,TRPV通道的这一区域与脂质的相互作用是动态的,可能会影响通道功能。研究者观察到没有添加脂质的大鼠TRPV2全长具有更宽的孔,这与添加脂质促进截断的兔TRPV2脱敏状态的假设是一致的。然而,全长TRPV2和截断的TRPV2的结构差异也可能是由许多变量造成的,包括TRPV同源物之间固有的结构差异、N端和c端氨基酸的缺失以及孔转塔的截断以及用于冷冻电镜的生化蛋白制备的差异。
低温电镜技术正在彻底改变人们探索跨膜通道结构的方法。在此研究中,研究者通过冷冻电镜分析,对“最小”TRP香草样亚型1 (TRPV1)的结构分析阐明了激动剂通过改变其外孔区域激活通道的机制。在~ 5 Å分辨率下确定的全长TRPV2的结构——与TRPV1一样,包含两个缩窄,分别位于成孔的上、下通道。与封闭的和激活的TRPV1相比,不含激动剂的TRPV2全长具有更宽的上下门。这些新发现的结构特征有助于研究TRPV通道的多样性,揭示这一大型离子通道超家族的不同调节机制和功能。
冷冻电镜成像技术(Cryo-EM,Cryo-ET)能够在分子生物学研究、细胞学研究乃至医学临床研究中发挥决定性的作用。鑫研微末团队在生物大分子及其复合体的三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
微末生物
Nanomega CyroAI
欢迎加入公司冷冻电镜技术讨论群 一起讨论
添加公司客服马老师微信,备注“加群”
期待与您交流!


小
年
纳
福

凯斯西储大学医学院药学系Kevin W Huynh为本文第一作者, Vera Y Moiseenkova-Bell 为通讯作者。
原文链接:
https://www.nature.com/articles/ncomms11130
点击“阅读原文”,查看文章↓
内容中包含的图片若涉及版权问题,请及时与我们联系删除

