
点击蓝字 关注我们

微末生物
Nanomega CryoAI
病毒如何复制自身并组装成新的病毒粒子?这些过程在哪里进行?这在病毒学上是一个重要的问题。据此前研究报道,病毒在一个类似细胞器的凝聚体(也称为病毒工厂)内组织它们的基因组复制、转录和衣壳组装,但是我们对这些凝聚体还未研究深刻。比如,这些凝聚物在细胞环境中的以什么空间结构组织在一起?它们在促进复杂病毒复制过程中到底发挥什么作用?
为了详细回答这些问题,2024年12月6日,加州大学洛杉矶分校周正洪教授团队在Nature Communications发表题为“Molecular sociology of virus-induced cellular condensates supporting reovirus assembly and replication”的研究成果。团队使用冷冻电子断层成像(CryoET)和单颗粒冷冻电镜(CryoEM)技术,探索了哺乳动物呼肠孤病毒(mammalian reovirus, MRV)诱导的细胞凝聚体(cellular condensates)的三维结构及其细胞内时空变化,揭示了该病毒在体内进行的基因组复制和衣壳组装的过程和机制,为完善“分子社会学”(病毒与宿主细胞的分子组织和相互作用)提供了新的思路。
病毒工厂:细胞的秘密空间
病毒感染细胞后,会在细胞质中形成一种特殊的结构,被称为“病毒工厂”,属于“细胞凝集体(cellular condensates)”的一种。作为无膜细胞器的一种,细胞凝集体虽不像经典细胞器如线粒体一样长期存在,但是却也发挥着重要作用:近年来报道中,其参与DNA复制、RNA转录、蛋白质合成等关键生物学过程,并在细胞信号传导、能量储存、神经退行性疾病(如帕金森和阿尔兹海默症)的发展中扮演重要角色,是维持健康的细胞稳态、引起疾病的组织功能障碍的利器。
同样,在病毒生命周期中,病毒在这种类似细胞器的浓缩物中组织基因组复制、转录和衣壳组装,不仅提高其复制效率,也能保护病毒中间体免受宿主攻击。散点分布的“病毒工厂”还可以像液体一样生长和融合,就像细胞内部的“秘密空间”,为病毒复制和组装提供了独特的环境 (图1)。
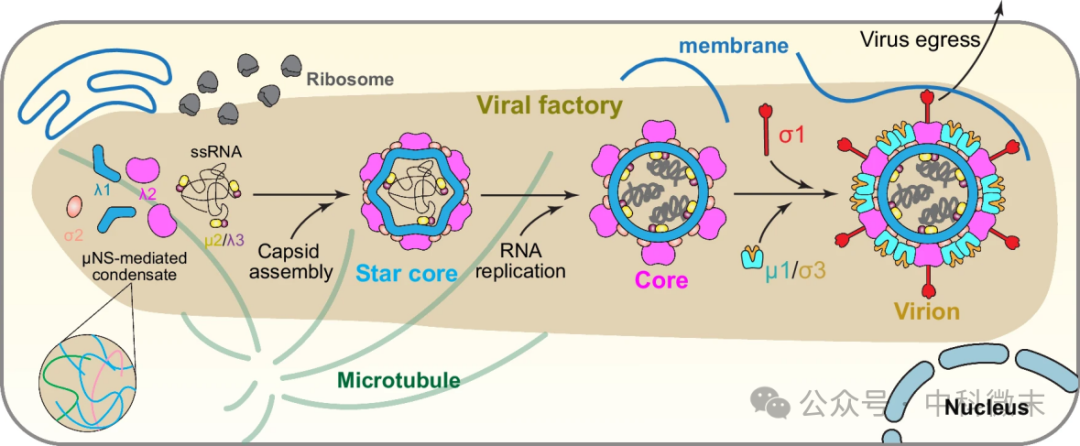
图1:细胞凝聚体中MRV组装和复制的卡通图
MRV病毒工厂的3D结构
哺乳动物呼肠孤病毒(MRV)属于dsRNA病毒,其感染可以导致多种疾病,其进入细胞后,经历了包括剥离外层蛋白质、成为感染性亚病毒粒子(ISVP)、成为核心粒子等一系列步骤,随后将在MRV诱导的细胞凝聚体中进行随后的RNA转录、基因组复制和子代病毒组装;但在最后的这些过程中,只有少量的中间体结构被识别,重要的过程和额外的瞬态均需探究。
因此,在这项工作中,为了探索凝聚体的结构和MRV在其中的复杂活性,研究者聚焦MRV诱导的细胞凝聚体的形态,和感染后6h(感染早期)和48h(感染晚期)两个时间点宿主细胞的变化。
较低倍率的冷冻电子显微CryoEM图像清楚显示,MRV病毒工厂是细胞质的、无膜的凝聚体,结合活细胞显微镜,揭示了从感染后6h到48h,多个分散的小型凝聚体(图2b)融合成大型凝聚体(图2g)。
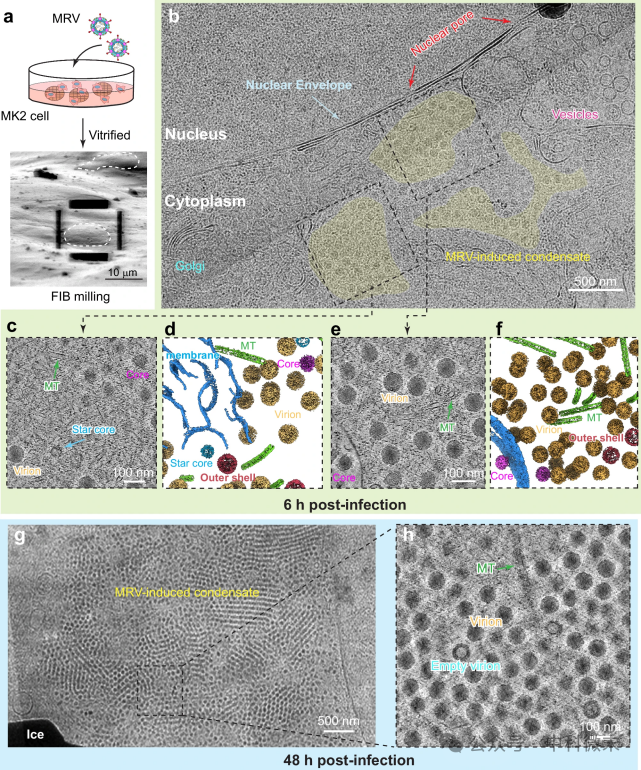
图2:CyroET观察宿主细胞中MRV诱导的细胞凝聚物
通过更高倍率的冷冻电子断层扫描(Cryo-ET)技术成像,能更详细地看到这些凝聚物周围和内部的细胞结构,包括宿主的微管、核糖体、脂膜、线粒体、高尔基体、囊泡和细胞核(图2c-f、h),解释了微管在凝聚物中的重要作用、内质网膜参与病毒工厂的形成、病毒mRNA的翻译发生在MRV病毒工厂内等结构和功能的关系。
总之,CryoET帮助我们显示了MRV诱导的细胞凝聚物的3D结构,包括它们随时间的形态变化,直观地观察病毒诱导的细胞凝聚物的原位时空组织(即分子社会学)。
病毒在凝聚体中组装中间体
从细胞和细胞器层面了解后,CryoET技术还可深入关注病毒组装中间体和产物(图3a,b)。
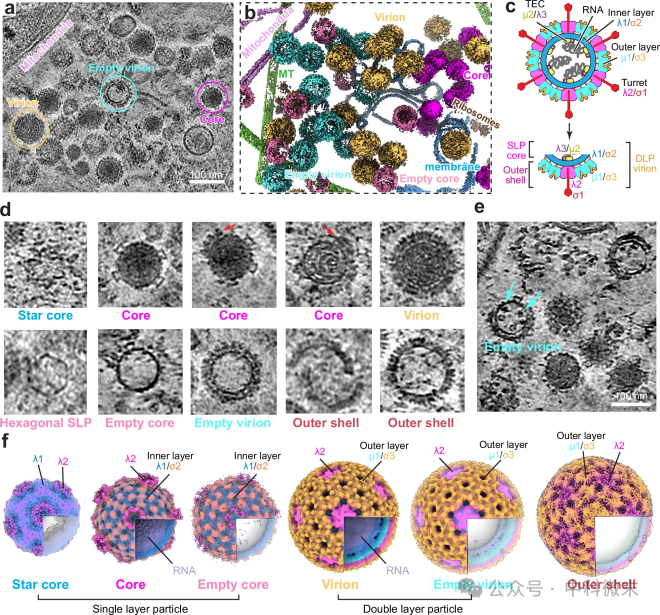
图3:细胞CryoET捕获的MRV组装中间体和产品
MRV病毒粒子由两个同心蛋白层组成,包封10个dsRNA片段(图3c), 在冷凝物中观察到单层(仅内壳)和双层颗粒,内部有或没有基因组RNA(图3a,d), 6个二十面体重构(图3f)
通过对感染后6 h和48 h的细胞断层图进行亚断层图平均,可以获得每个时间点MRV组装状态的6个二十面体重构(图3f),有以下一些分析(图2、3a):
①6个二十面体重构包括:星核star core、核core、病毒粒子virion、空核empty core、空病毒粒子empty virion和外壳粒子outer shell
②MRV早期组装状态:单层颗粒(星核、核和空核),仅由内层蛋白质组成;
③MRV成熟的产物:病毒粒子和空病毒粒子
④MRV组装的副产品:由外层蛋白μ1、σ3和λ2组成的外壳粒子,缺乏任何内层蛋白质或RNA基因组,感染后期更多;
⑤病毒的中间体和产物:核和病毒粒子,无序地聚集,没有清晰的空间分布模式。
通过细胞断层分析,研究者确定了六个装配中间体和几个瞬时存在状态,为MRV逐步组装提供了新的、细的快照。
病毒组装中间体和产物的原子结构
进一步地,为更高分辨率地观察感染后6h和48h的中间体和产物,采用CryoEM观察和不对称亚颗粒重建,获得了五种病毒颗粒的近原子分辨率(高达3.0 Å)结构,构建原子模型(图4)。这些病毒工厂内部的多种病毒组装中间体的空间排列和转化过程构成了 MRV 的生命周期。
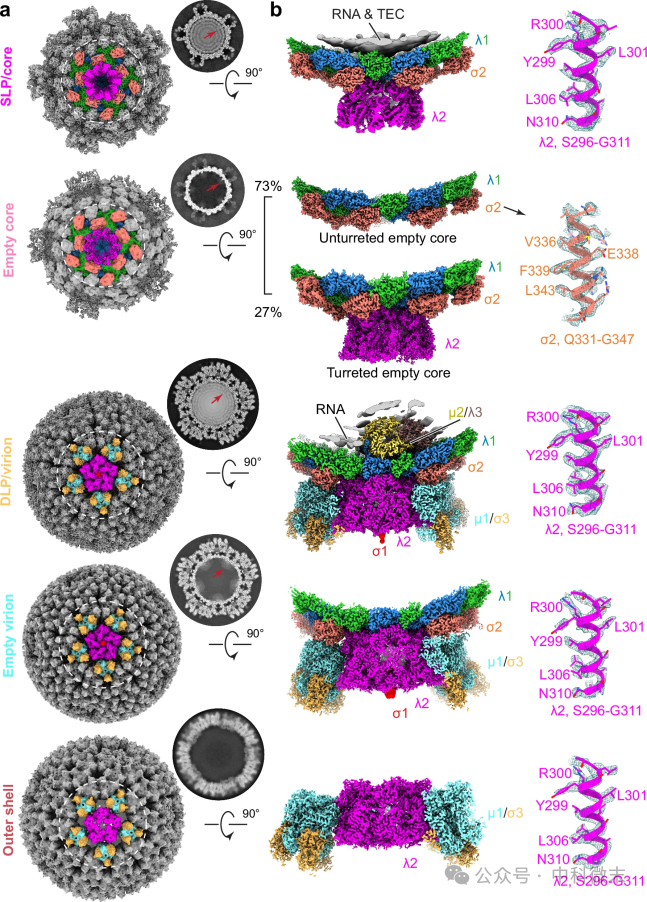
图4:病毒分离物CryoEM分析MRV组装中间体的高分辨率结构
a 为CryoEM图和相应的五种组装中间体的二十面体重建截面。b为从(a)的二十面体图中截取的亚粒子顶点重建。核、空核、病毒粒子为感染后6 h的数据。空病毒粒子和外壳来自感染后48 h的数据
病毒基因组的包装和MRV病毒粒子组装
呼肠孤病毒的衣壳形状为二十面体,具有5个五重轴和12个顶点。研究发现,MRV 的基因组包装是通过一个通道进行的,这个通道位于病毒蛋白外壳的五重对称轴上。
在组装的早期阶段,单链RNA通过这个通道进入核心,内衣壳蛋白与病毒的ssRNA基因组片段相互作用形成星型核心;最终复制成双链RNA并填充核心,使内壳从星形(star core)扩展成球形(core),当核心变为病毒粒子时,塔的另一端会关闭(图5a, b)。在此过程中,团队比较了MRV和此前研究的BTV,发现转塔蛋白λ2和λ1形成的通道类似于BTV中VP6和VP3形成的RNA结合通道(图5c,d),预示着两种病毒可能有相似的RNA包装机制。
关于蓝舌病毒BTV,该团队此前已联合使用CryoET和CryoEM展示了其模型结构,详见总结部分文章链接。
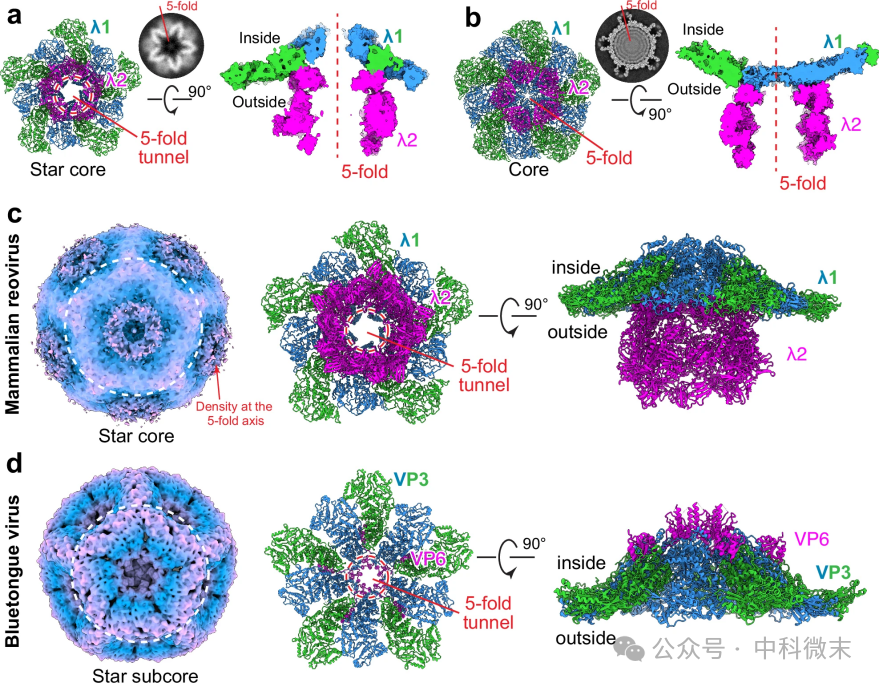
图5:MRV组装过程中衣壳从star core到core的拓展(a,b)及其与BTV的比较(c,d)
RNA的存在还促进了病毒蛋白外壳上转塔蛋白λ2的构象变化(图6),并帮助转录酶复合体稳定地附着在核心上。同时伴随着衣壳蛋白的构象变化,病毒从单层星核逐步组装成双层完整的病毒颗粒,表明病毒工厂是一个高度有序和动态的结构,其形成和功能受到精确的调控。
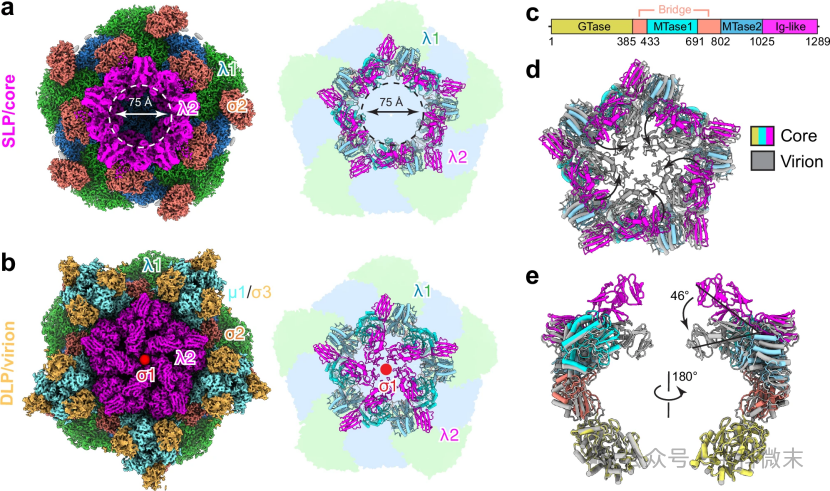
图6:MRV组装过程中转塔蛋白λ2的构象变化
MRV及其诱导的细胞凝聚体的稳定性和简单性,也提示了病毒作为一个简单模型,具有研究凝聚物机制及其与病毒复制和更广泛的细胞生物学的相关性的潜力。同时,病毒工厂作为相分离现象的模型系统,也具有极高的研究价值,为揭示相分离的生物学功能和机理提供了新思路。
总结·关于我们
病毒因其独特的生物学特点,长期以来在推动生物学基本过程的研究中发挥了重要作用。这项研究应用先进的CryoET和CryoEM,直接观察了诱导形成的凝聚体的三维结构,捕获了其中的各种中间体,从而详细勾勒了病毒在体内复制组装的途径及不同状态之间的变化,揭示了MRV基因组包装和衣壳组装背后的编排,包括空间上的组织和时间上的调节,为细胞内MRV感染的进展提供了“分子社会学”的视角。
这项研究强调了细胞凝聚体在病毒复制中的重要作用,不仅为我们理解病毒复制和组装的机制提供了新的见解,有助于深入理解病毒与宿主的复杂相互作用机制,也为进一步研究病毒感染和开发抗病毒药物提供了新的思路。展望未来,科学家们将继续利用冷冻电子断层扫描等先进技术,深入研究病毒工厂的结构和功能,希望以此为理论依据,开发出更有效的抗病毒治疗方法。
其实,Cryo-ET和Cryo-EM之前也层联手解决过许多细胞的、细胞器的、病毒尺度上的结构难题,回答了许多对关键生物学过程的疑问。例如在这篇关于蓝舌病毒BTV的结构中,较详细介绍了其原理,详见↓
目前,全球范围内能够使用冷冻电子断层扫描Cryo-ET这一强大技术的科技公司可谓凤毛麟角,而鑫研微末团队在Cryo-ET、Cryo-EM、Micro-ED等多项结构生物学高精尖技术方面已经具备成熟的结构解析经验和系统性的实验方案。多篇CNS综述已经指出,Cryo-EM、Cryo-ET技术的发展和运用决定了结构细胞生物学界,乃至整个生物医药界的未来。鑫研微末团队在生物大分子三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
加州大学洛杉矶分校周正洪教授为本文通讯作者,刘晓玉博士和夏显博士为共同第一作者。
原文链接:https://www.nature.com/articles/s41467-024-54968-7
点击“阅读原文”,查看文章↓
微末生物
欢迎加入公司冷冻电镜技术讨论群 一起讨论
添加公司客服马老师微信,备注“加群”
期待与您交流!

内容中包含的图片若涉及版权问题,请及时与我们联系删除

