
点击蓝字 关注我们

微末生物
Nanomega CryoAI
溶解性细胞死亡是一种主要由焦亡和坏死引起的炎性细胞死亡。溶解性细胞死亡结束时会发生细胞质膜破裂(PMR),并释放出称为损伤相关分子模式(DAMPs)的大尺寸细胞内分子,进而放大炎症反应。已有研究发现NINJ1是PMR发生的重要蛋白。NINJ1是一种16 kda的神经损伤诱导蛋白,具有2个跨膜螺旋(TMs)和1个细胞外两亲螺旋(AH)。通过寡聚化诱导细胞质膜破裂的发生,AH在这一过程中发挥了关键作用;然而质膜上与类AH结构类似的高度同源蛋白NINJ2却不能诱导PMR的发生。
为了进一步从微观层面探究NINJ1如何介导PMR以及NINJ2不能行使相同功能的原因,凯斯西储大学生理与生物物理系戴兴红教授及其团队通过使用冷冻电子显微镜(cryo-EM)解析确定了NINJ1和NINJ2的分子结构,并对其进行了比较。
冷冻电镜(Cryo-EM)解析
NINJ1和NINJ2大分子的三维结构
由于已经证明NINJ1介导的PMR与NINJ1蛋白寡聚化相关,研究者想探索NINJ2是否也能够寡聚化。通过在悬浮细胞中表达N端3xflag标记的NINJ2并纯化后,在凝胶排阻层析(SEC)中观察到一个宽峰,且cryo-EM显示出椭圆形到带状颗粒状的各种分子,均表明体外纯化的NINJ2形成线性低聚物,可能与NINJ1类似。通过调整纯化策略获得更均匀的样品后,研究者通过低温电镜建立了NINJ2的原子模型(图1D)。NINJ2低聚物看起来像一个微拱桥(图1B),两个侧壁由反平行方向的交联NINJ2亚基组成(图1D),夹着两层脂质作为桥的甲板。这两个脂质层的几何形状明显类似于生物膜中的脂质双分子层(图1C和1D),表明它们是内源性脂质且与蛋白质紧密相关。由于预测NINJ2的拓扑结构在N端和C端都是胞外的,在对蛋白质密度进行建模后区分为两种脂质层,将它们称为“外质小叶”和“细胞质小叶”(图1D,即细胞膜的外层和内层磷脂分子)。
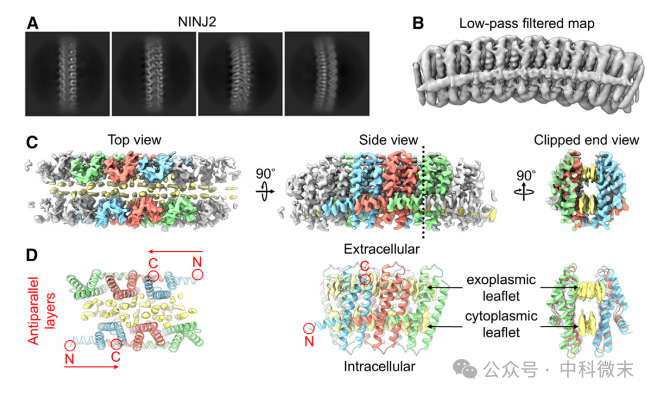
图1.NINJ2和NINJ1低聚物的低温电镜结构
随后研究者通过细胞培养基部分进行NINJ1纯化达到了与NINJ2类似的产量。发现纯化的NINJ1低聚物在阴性染色电镜和低温电镜下看起来与NINJ2相似,呈丝状,但与NINJ2低聚物相比看起来更细,更少弯曲,两个反平行的蛋白质层夹在薄的脂质双分子层中。除了不同的弯曲程度外,这两种细丝之间的另一个显著区别是与蛋白相结合的脂质。
尽管NINJ1和NINJ2低聚物的弯曲程度不同,但它们各自的亚基在结构上非常相似,因此它们的分子间相互作用可能是导致低聚化的原因。据预测,NINJ1和NINJ2都有一个细胞外N端,一个AH,随后是两个TMs(TM1和TM2)和一个细胞外C端。由Alphafold2预测的NINJ1(或NINJ2)结构23与研究者在TM1和TM2区域发现的低温电镜密度图非常吻合,但实际上有两个AH(AH1和AH2),在残基Met51周围呈近90弯曲(Met37) (图2A和2G)。AH2在两个相邻亚基的交界面上与TMs的上半部分捆绑在一起,而AH1在相邻亚基中横向延伸至TMs的中下部分(图2A和2G)。AH1的这种交联可以在扭结处进行轻微的铰链运动,同时保持丝状结构的完整性和丝状结构的横向灵活性。
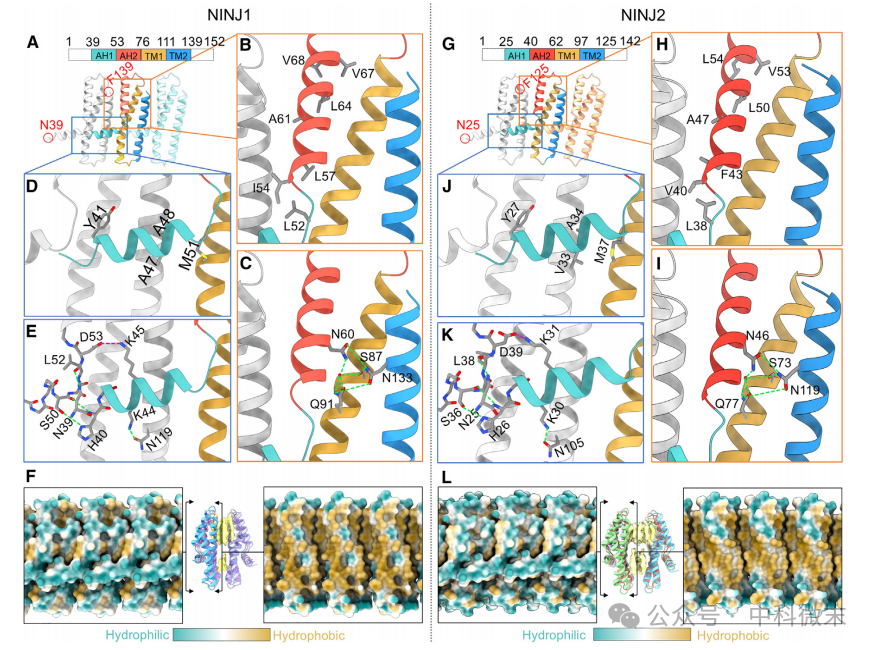
图2.组装NINJ1、NINJ2细丝的原子相互作用
亚基内的TMs之间、相邻亚基之间以及与AH2或AH1的疏水侧之间存在丰富的疏水相互作用(图2B、2D、2H和2J)。研究者认为相互作用是特别重要的,在这方面,AH2上的Asn60 氨基酸(Asn46)则格外重要,因为它由一个H2O分子介导形成了一套氢键网络,具有高度保守的三极性氨基酸残基,分别是TM1上的Ser87 (Ser73), TM1上的Gln91 (Gln77)和TM2上的Asn133 (Asn119) (图2C和2I)。这些相互作用是在同一个亚基内,似乎导致了蛋白质骨干的旋转,这反过来又使剩余的N端线圈区域朝向丝的一侧,并避免了与下一个亚基的AH1的位阻 (图2E和2K)。NINJ1或NINJ2的丝状组装体的表面渲染显示出面向体溶液的高度亲水性,与另一侧保持高度疏水性并与脂质双分子层紧密结合形成鲜明对比 (图2F和2L)。NINJ1长丝的这种独特的表面特性对其介导PMR这种细胞生命活动的功能有很大的影响。
NINJ1和NINJ2纤维的相关细胞膜磷脂有明显差异。与NINJ2相比,NINJ1纤维在两个蛋白质层之间捕获的脂质更少。在NINJ2中,脂质密度相对较弱且连续(图3D),但在NINJ1中,脂质密度非常强且呈点状分布,每个点状可见6条脂肪链(图3A)。这些脂肪链密度在NINJ1中的每一个都可以在NINJ2中相对于蛋白质侧壁的相应位置找到匹配。与NINJ2相比,NINJ1的外质小叶与该蛋白的联系更为紧密。研究者认为,在小鼠、人类和大鼠中,四个高度保守的NINJ1和NINJ2序列变异可能导致了外质小叶中脂质关联的差异。在细胞质小叶上,NINJ2的每个亚基与三种脂质密度相关,包括一种非常突出的胆固醇样密度和两种稍弱的脂肪链样密度(图3D和S4B)。而在NINJ1中,每个亚基只与一个脂质密度相关,研究者将这种密度建模为胆固醇(图3C)。造成这种细胞质小叶脂质关联差异的最显著的序列变异可能是NINJ2的Gln103和NINJ1的Phe117。Gln103可以与进入的胆固醇的羟基形成氢键(图3F),而体积庞大的Phe117在空间上阻碍了胆固醇在这个地方的结合(图3C)。NINJ1的TM1, Phe100的粗侧链(对应于NINJ2中的Val86)也可能阻断了该位置的脂质结合(图3C和3F)。结果,在NINJ2中观察到的三种相关脂质在NINJ1中只有一种(图3F与3C)。
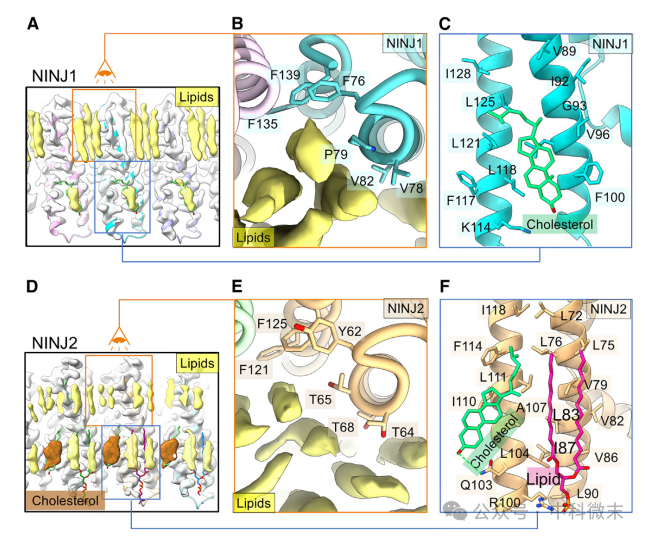
图3.蛋白-脂质相互作用影响NINJ1和NINJ2纤维的曲率
NINJ1和NINJ2纤维在蛋白-蛋白相互作用方面高度相似。研究者假设它们在脂质结合方面的差异导致了它们不同的曲率,并最终导致了它们介导PMR的不同能力。为了验证这一假设,该研究在NINJ1和NINJ2之间交换了上述脂质相互作用残基 (图4A),并测试了其对纤维组装和PMR能力的影响 (图4B和4C)。交换发现,NINJ1-M9突变体的表现或多或少类似于NINJ2-WT(野生型),具有轻微弯曲的细丝,且不影响细胞生存。然而NINJ2-M9突变体的表现不像NINJ1-WT——它对细胞的杀伤能力仍然很低。纯化试验表明,它完全无法组装成细丝。通过对结构的更仔细的检查,推测在NINJ2-M9中,V86F突变可能引起了来自邻近亚基的Trp99(对应于NINJ1中的Ala113)的粗大侧链位阻,从而阻止了细丝的组装。实际上研究最终发现,NINJ2-M9+W99A突变体部分获得了PMR能力,杀伤分数接近0.5 。该突变体纯化后发现了高度倾斜的细丝和许多小圆盘状结构的混合物。正如后来解释的那样,这些圆盘可能是PMR产物,它们只在NINJ1-WT中出现,而在NINJ2-WT中没有出现。NINJ1 -M4exo和NINJ2-M5cyto突变体在脂质结合残基上几乎相同,然而NINJ1- m4exo杀伤分数却相对较高(~0.5),结构为野生型样的细丝和圆盘。看起来在NINJ1的外质小叶上存在着非常强的脂质关联,这可能对其PMR有所贡献。其中,构建的NINJ2-Q103F单点突变可以特异性地破坏细胞质上强烈的胆固醇结合。正如预期,NINJ2-Q103F的杀伤分数(~0.4)与之相符,纯化后富含短而直的细丝和圆盘状颗粒,都表明其PMR能力。这些结果表明,在细胞质叶中存在强烈的脂质关联,特别是与胆固醇分子结合,对NINJ1的PMR能力有主要的负向调控。两个小叶上强烈的脂质结合彼此不相容,它们的竞争会破坏介导PMR所需的相对长而直的细丝的组装。结合上述突变结果和结构信息,可以从机制上解释脂质关联如何影响NINJ1或NINJ2的丝曲率。
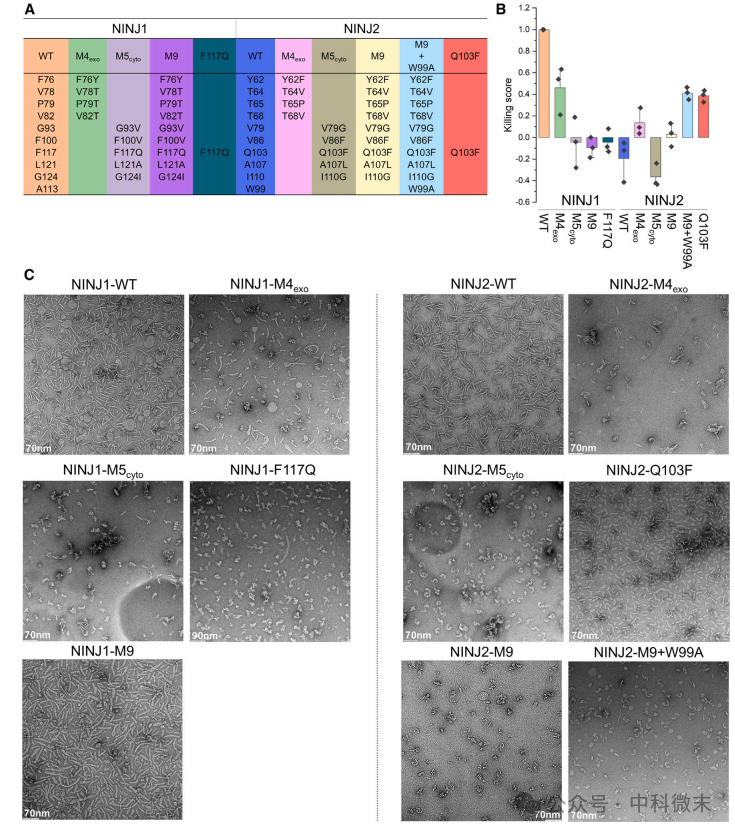
图4.使用冷冻电镜观察突变体对NINJ1或NINJ2纤维组装及诱导PMR能力的影响
虽然NINJ1和NINJ2结构都是双层细丝,但几乎没有观察到两层之间的蛋白质-蛋白质相互作用。这两层仅仅是通过疏水相互作用与夹在中间的脂质结合在一起的,这预示天然膜环境中蛋白本身为单层细丝。膜支架蛋白(MSPs)广泛用于制备脂质纳米盘,通过膜蛋白的低温电镜结构研究发现了一种PMR机制,通过这种机制,NINJ1纤维缠绕在膜碎片上,使其从质膜上“溶解”,使膜泄漏给大分子,如DAMPs。在纯化的NINJ1样品的阴性染色电镜照片中的确可以大量观察到脂质纳米圆盘状组装,但在NINJ2样品中却没有,这些观察结果强烈表明这种蛋白质辅助的膜裂解可能是NINJ1介导的PMR的机制,而孔隙形成起次要作用。
基于研究的细胞死亡模型
对于任何细胞来说,维持质膜完整性是极其重要的生物行为,因此NINJ1的作用必须处于严格的调节之下。NINJ1在许多类型的细胞的质膜上组成性表达。在健康细胞中,它们必须采用相对稳定的构象(此处称为“静息状态”),以防止它们自发过渡到此处所见的丝结构。关键是隐藏TM螺旋的AH结合接口,使AH不能轻易地对接。此外,在TM螺旋的一侧存在一束极性残基,如Ser87、Gln91和Asn133(三联体),与丝结构中AH上的极性残基(如AH2上的Asn60)相互作用(图2C),但在静息状态下需要通过其他方式从疏水膜环境中屏蔽。研究者提出了一种解决这两个难题的方法是形成NINJ1的同型二聚体,它们的TM螺旋的AH结合界面彼此面对,极性残基在间隙处跨越两个亚基相互作用。NINJ1二聚体和其低聚物在静息状态下的存在的假设解释了NINJ1环和盘是如何以相反的拓扑结构同时形成的(图5)。
当细胞被触发裂解细胞死亡时,质膜被鼓胀和收缩拉伸。这可能在某种程度上促进了NINJ1二聚体和二聚体低聚物聚集成更长的二聚体链,就像袋子上的拉链一样。膨胀的质膜的横向张力会从拉链的两侧拉过来,削弱穿过中心线的相互作用。当张力超过某一点时,拉链可能会裂开,允许AHs向下折叠并与相邻的亚基交联。当这种分裂和交联反应在拉链的整个长度上传播时,一个孔就会形成并扩大。如果拉链中的所有NINJ1亚基都发生交联,则会在质膜上留下一个中间有孔的NINJ1环。在热力学的驱动下,NINJ1的断裂环将继续延伸成细丝,并最终以疏水的一面缠绕在膜碎片上。
该研究通过低温电镜技术构建了NINJ1与NINJ2的结构模型,并进行了相关分析和假说验证,解释了NINJ1在健康细胞中的惯性及其在垂死细胞最后时刻的破膜作用,为探究细胞重要的生命过程奠定了结构基础。
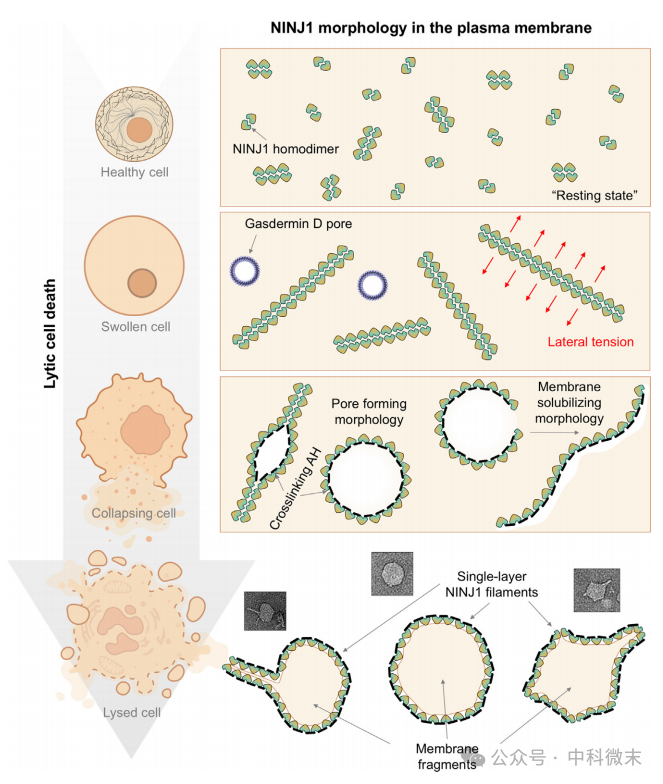
图5.NINJ1激活和PMR 的机制模型
关于我们
冷冻电镜成像技术(Cryo-EM,Cryo-ET)能够在分子生物学研究、细胞学研究乃至医学临床研究中发挥决定性的作用。鑫研微末团队在生物大分子及其复合体的三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
微末生物
Nanomega BioAI
欢迎加入公司冷冻电镜技术讨论群 一起讨论
添加公司客服马老师微信,备注“加群”
期待与您交流!

内容中包含的图片若涉及版权问题,请及时与我们联系删除

