一、
基于 Summit Therapeutics 公布的 HARMONi 3 期临床试验结果,判断其 PD-1/VEGF 双特异抗体 ivonescimab 是否能获得 美国FDA批准(BLA),我们可以从以下几个维度进行分析:
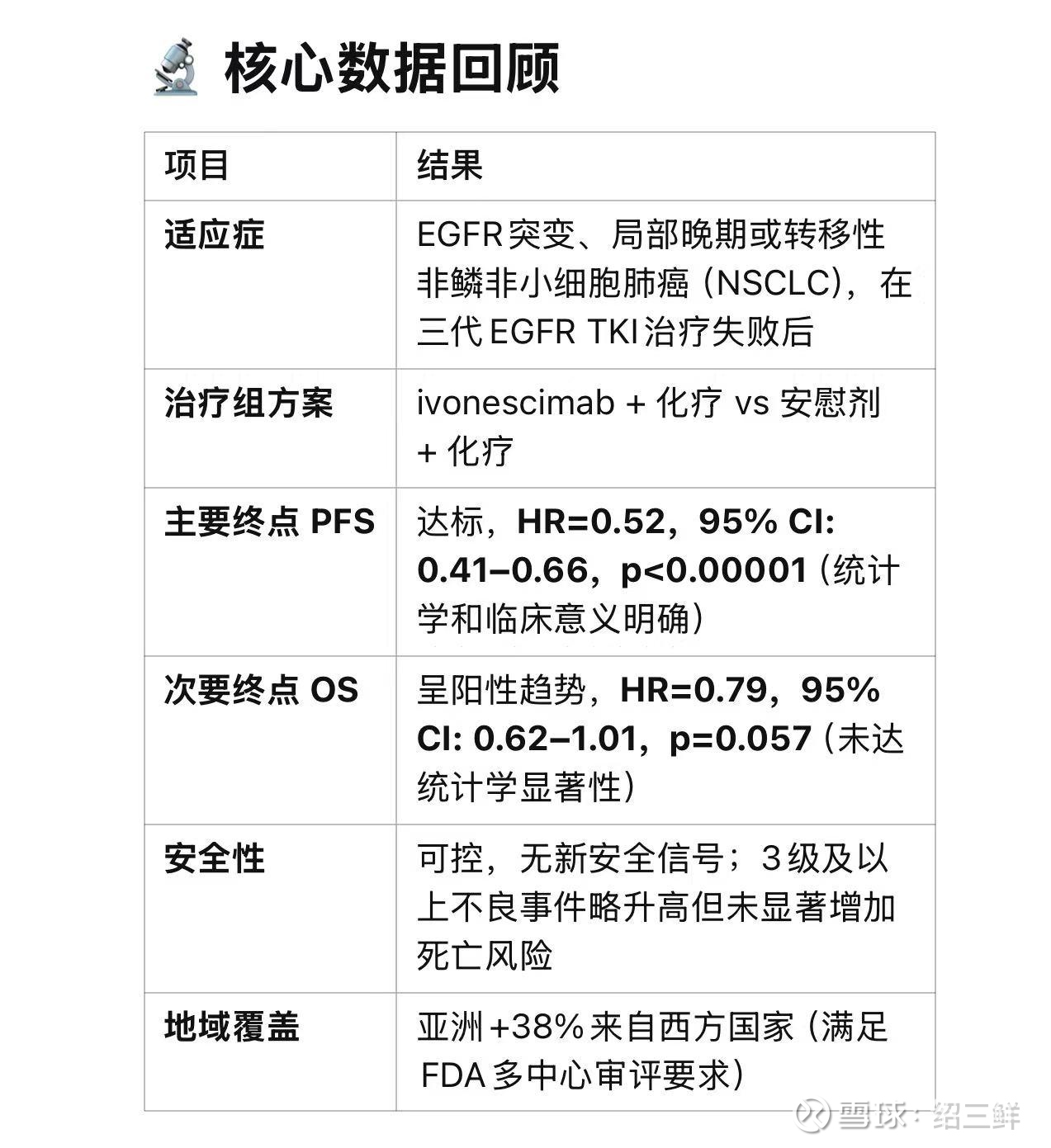
积极因素支持 FDA 潜在批准
PFS 显著且临床意义强:
HR=0.52 是一个非常积极的数据(约48%风险降低),在临床肿瘤学中被视为显著有效。
尽管OS未达统计学显著,但趋势明显(HR=0.79,接近临界值),这在无法治愈的晚期NSCLC领域可能具备“合理替代性”。
未满足人群中的“唯一有效方案”:
EGFR TKI失败后的NSCLC患者,目前无FDA批准疗法可提供显著OS或PFS获益。
当前PD-1/PD-L1单抗(如Keytruda)在该人群中失败(过去试验未获益),而ivonescimab是首个在该设定中取得阳性PFS结果的免疫治疗药物。
符合多区域研究和人种差异评估要求:
西方患者占比38%,符合FDA对于全球多中心研究中美国人群代表性的要求。
在中国已获批(基于HARMONi-A):
同类适应症在中国监管部门已通过审批,可作为间接支持证据。


建议总结(面向投资人或临床关注者):
目前数据支持“潜在批准”,但路径更可能是“加速批准”或“推迟BLA后批准”。
OS虽然未显著,但趋势良好,存在补救机会(进一步随访可能提升显著性)。
如果Summit选择暂缓提交BLA至OS数据更成熟,则FDA批准可能性将明显提高。
若在2025年提交BLA,预计FDA会要求严格审查临床获益与未满足需求的权衡。
二、
预测 AK112(依达方®,ivonescimab)的 总生存期(OS) 数据走向,可以结合其 临床机制、生物特性、现有PFS数据、对照药物表现、真实世界使用场景 等因素进行推演。以下是基于当前已知信息的分析和预测:
临床背景与已知数据
1. 适应症背景:EGFR-TKI治疗失败后的NSCLC
这一人群在既往临床中被称为“免疫耐药人群”,对传统PD-1抑制剂如Keytruda(帕博利珠单抗)几乎无效。
当前无FDA批准的治疗在此人群中显著延长OS。
2. AK112已知PFS数据(HARMONi-A试验)

虽未达统计学显著,但已经逼近边界(p≈0.05)。
与已上市药物对照,这一OS数据在该患者群体中属领先水平。
机制层面支持长期OS获益 AK112 是 PD-1 与 VEGF 的双特异性抗体: PD-1 免疫抑制解除 + 抗血管生成(抗VEGF):
理论上更适合肿瘤免疫微环境抑制强、抗血管生成需求高的NSCLC(尤其是EGFR突变后免疫抑制强化的人群)。
同步打击免疫逃逸与肿瘤营养供给,是其区别于传统PD-1/PD-L1单抗的关键。
因此,在具备早期疾病控制(PFS提升)的同时,也可能延长长期OS。
预测 OS 的走向(基于统计模型与类比药物)

通常在PFS显著提升(HR<0.5)时,OS如果初步趋势阳性,后续随访会逐渐显著(HR < 0.75)。
FDA批准的多款药物在提交BLA时OS HR为0.800.85,最终随着随访时间延长,有些HR下降至0.70 0.75。
预测结论:AK112在不同设定下的 OS 潜力
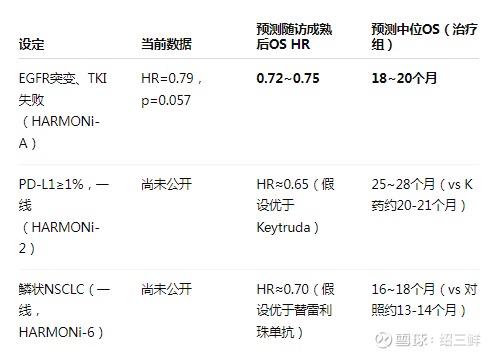
结论总结 AK112 的 OS 数据有望随着随访时间的延长而进一步改善,HR 值可能下探至 0.72~0.75 区间,并达到统计学显著性。
在真实世界的联合化疗应用中,其 PFS 与疾病控制率优越,为 OS 提供了良好的基础。
若后续OS成熟数据印证趋势,其在全球监管层面(如FDA)将具备较强申报基础,尤其在无有效疗法的EGFR突变二线NSCLC中。
三、免疫疗法的长尾效应对os hr数据的后续影响
免疫疗法的“长尾效应(tail effect)”确实会对 OS(Overall Survival) 的 HR(Hazard Ratio)演变 产生显著影响,尤其在中长期随访时。
什么是“长尾效应”(Tail Effect)
在肿瘤免疫治疗(特别是PD-1/PD-L1抗体)中,部分患者在接受治疗后能获得极持久的生存期,即使大多数患者在短期内进展或死亡。
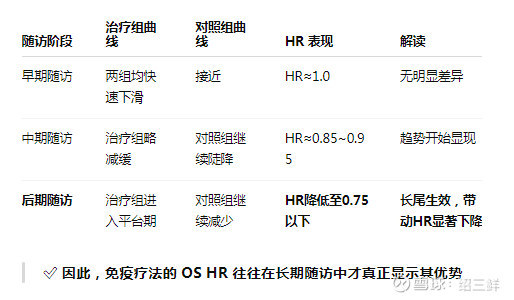
表现:
初期 OS 曲线无明显优势,甚至与对照组相似
随着随访时间延长,治疗组 OS 曲线下滑减缓
最终形成“尾部抬起”的 plateau(平台期)
这就是所谓的“长尾效应”:小部分患者长期生存,带动整体 OS 平均值拉高,但往往出现在试验后期。
长尾效应对 HR 的影响机制
HR(Hazard Ratio)是瞬时风险比:随时间不同而可能发生变化。
真实案例:免疫药物HR演变案例:
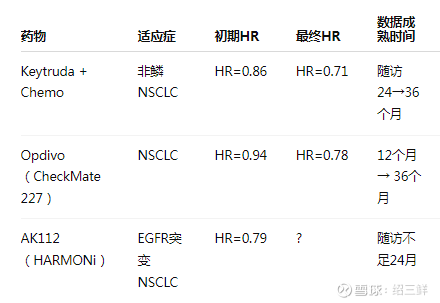
AK112 的OS数据:可能如何演变? 当前(中期): HR = 0.79,p=0.057,尚未达显著性
多数患者 OS 尚未到达中位数,尤其是欧美人群
预测(长尾效应发酵): 若尾部患者比例较高(如10~15%人群 >24月无进展)
随访延长至 3036 个月,HR 有望降至 0.720.75
p 值有望降至 <0.04,达到统计学显著
因此 AK112 是否能最终达成 FDA 要求的 OS 显著性,很大程度上取决于是否具备“长尾生存群体”以及其比例大小。
$康方生物(09926)$ $Summit Therapeutics(SMMT)$
本话题在雪球有15条讨论,点击查看。
雪球是一个投资者的社交网络,聪明的投资者都在这里。
点击下载雪球手机客户端 http://xueqiu.com/xz]]>

