
点击蓝字 关注我们

微末生物
Nanomega BioAI
前言
你是否想过,病毒是如何从细胞中逃逸出来,去感染其他细胞的呢?其实,它们就像狡猾的小偷,会偷偷利用细胞的“运输系统”来完成这个任务。
这篇研究揭示了能引发脑炎的疱疹病毒利用神经元胞吐过程进行传播的秘密。胞吐,是细胞将囊泡中的物质释放到细胞外的过程,就像快递员将货物从仓库运送到收件人手中。神经元将神经递质等物质打包成一个个小包裹(囊泡),然后通过细胞外排将它们“快递”到细胞膜上,与细胞膜融合,最终释放到细胞外,传递信息。而病毒,就像搭乘运输车的“乘客”,借助囊泡的帮助,从被感染的神经元出发,前往其他神经元,甚至引发脑炎。但是由于其具有动态性和缺乏高分辨率3D结构解析工具,该过程的详细机制尚不清楚。
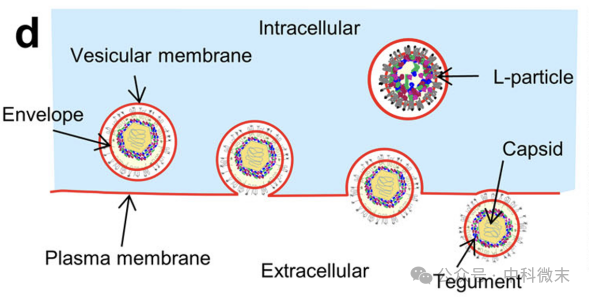
图1:病毒通过胞吐作用排出细胞外的示意图
来自加州大学洛杉矶分校(UCLA)的周正洪教授作为通讯作者带领团队在Cell Discovery上发表文章Biphasic exocytosis of herpesvirus from hippocampal neurons and mechanistic implication to membrane fusion,通过冷冻电子断层扫描技术这一关键技术,观察到一种PRV病毒如何劫持细胞外排机制进行传播。他们发现,PRV 的外排过程分为两个阶段:
释放阶段:囊泡快速与细胞膜融合,打开“通道”,将病毒释放出去。
恢复阶段:囊泡与细胞膜的“通道”逐渐关闭,恢复原状。
这个过程就像快递员送货后又将仓库门关上,确保下一次送货顺利进行。
这项研究首次从结构上研究膜融合步骤以及随后的胞吐步骤,揭示了病毒传播的微观机制,为我们理解病毒感染和脑炎的发病过程提供了新的线索、为理解其他细胞外排过程提供了新的视角。
今天的主角是广泛使用的α-疱疹病毒(PRV),也是研究大脑回路的示踪剂。病毒感染神经元后,会在细胞内大量繁殖,形成两种粒子:有感染性的病毒颗粒和没有感染性、但起到促进感染作用的L-颗粒。
另一主角是PRV感染后的海马神经元,具有稀疏生长的轴突和树突,非常适合研究顺向运输和病毒的释放,成为研究囊泡胞吐动态机制的绝佳模型。
曝光病毒的秘密的工具技术是新一代冷冻电镜技术——冷冻电子断层扫描 (cryo-ET) ,通过将以上两个主角样品浸入液态乙烷中进行快速冷冻,可以实现在近原生状态下保存细胞和病毒。此外,快速玻璃化使科学家能够捕获释放过程中不同阶段的病毒。于是,团队可以获得高质量的三维结构,避免细胞结构的可能重叠。
cryoET捕捉到病毒用胞吐逃逸的“现场照片”
首先,团队用cryoET观察并鉴定病毒胞吐的定格瞬间:感染后14-16小时病毒颗粒开始出现在与质膜相互作用的囊泡中(图2)。为了“不抓错嫌疑人”,团队谨慎地排除了观察到的囊泡为子代病毒颗粒的胞吞阶段等其他可能,理由如下:由于该种病毒侵染细胞不通过囊泡形式(并通过cryoCLEM 显微镜进行验证),且感染时间经有关研究报道为最佳胞吐时间,以及神经元密度低,选择拍照的区域仅包括单轴突或树突,排除了病毒逆向或被挤压在间隙的可能。因此,也证明了图中的“子代病毒在外排”的身份,更具有说服力。

图2:海马神经元的轴突的重建断层图切片,显示轴突处病毒的单颗粒胞分泌(b)和树突中L-颗粒的单颗粒胞分泌(c)
病毒的“个人作案”和“团伙作案”
通过仔细分析3D结构,团队确定了两种不同类型的与质膜相互作用的病毒粒子囊泡:
第一种,也是占主导地位的是单粒子型胞吐的囊泡,即包含一个病毒粒子(图2)。这种包围单个病毒粒子的囊泡膜与质膜融合,形成一个腔室和一个孔。腔室内部的病毒包膜由一层独特的蛋白密度(图2中的蓝色箭头)排列,而暴露在孔外的包膜则被糖蛋白刺突(图2中的黄色箭头)装饰。
第二种类型,是多粒子型胞吐的囊泡,亦即包含多个粒子(图3)。推测“豌豆夹”型可能由于囊泡与释放腔串联融合所引发,“垃圾袋”可能是单个囊泡包围多个粒子与质膜融合引起的。
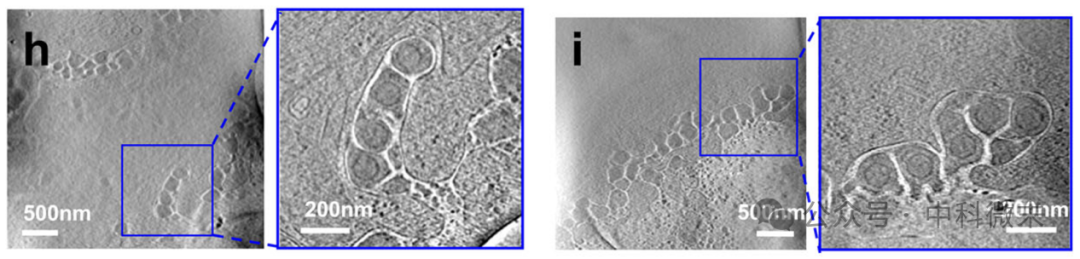
图3:形象的多粒子型“豌豆夹”(左)和“垃圾袋”(右)
用照片估算“作案时间”——累积频率分析估算胞吐作用的相对时间
就像高中生物实验中,在显微镜下观察有丝分裂的不同阶段时,因为分裂间期时间最长,所以看到的大部分细胞都处于间期一样;由于冷冻电镜无法动态地观察这一过程,因此可以分析某一时刻的大量照片,以某阶段出现的频率表征该阶段相对时间长短(作者将其定义为相对经历时间)。
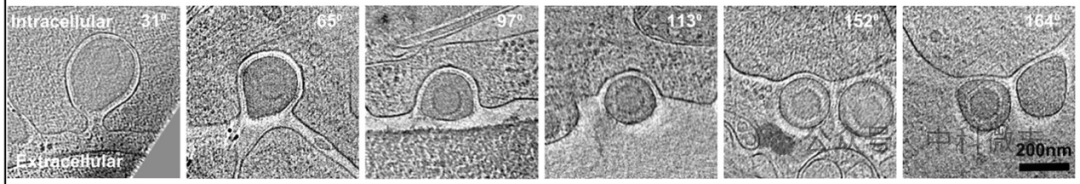
图4 快照——从融合到释放
那么,如何区分不同阶段呢?作者找到一个无关囊泡大小、单调递增的变量:孔膜角度(pore membrane angle),示意如图5c,图4右上角为该过程的孔膜角度值及变化情况。
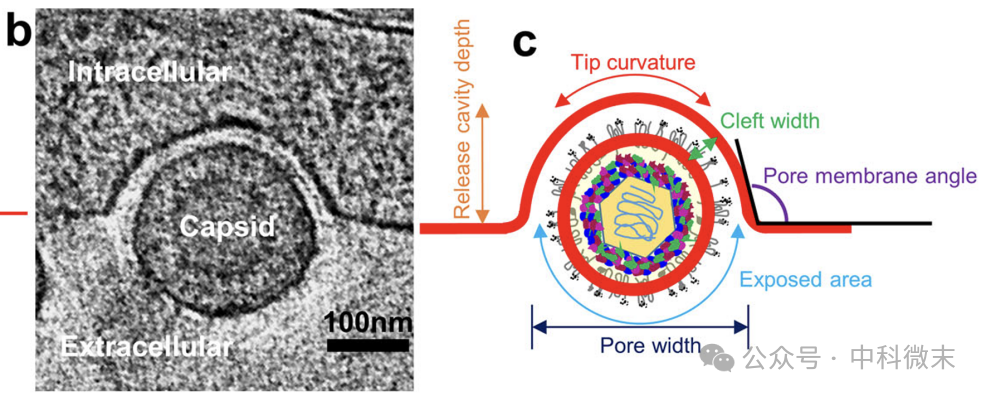
图5:实物图(b)和各参数的示意图(c)
除了表征阶段的这一变量,团队还选择了几个其他的观察参数,包括暴露面积占包膜总表面积的百分比、衣壳中心到释放孔平面的距离、释放腔深度、孔宽度、囊泡曲率、包膜曲率以及衣壳中心到包膜中心的距离。
病毒的“双相逃逸”
有了以上分析指标,团队发现,病毒颗粒的释放过程并非一蹴而就,而是分为两个阶段:
释放相:囊泡与细胞膜迅速融合,形成一个开放的孔道,病毒颗粒快速“逃离”细胞。
恢复相:囊泡与细胞膜的融合孔道逐渐缩小,细胞膜恢复正常形态,就像大门慢慢关闭,防止其他物质进入。
这两个阶段即下图中两个不同斜率的线性阶段,第一个阶段释放相的斜率大,速度快,第二个阶段恢复相的斜率小,速度慢。前者是后者时间的七分之一,但是病毒的移动速度却是后者的7.2倍!几个不同的参数显示相同的结论,相互佐证。
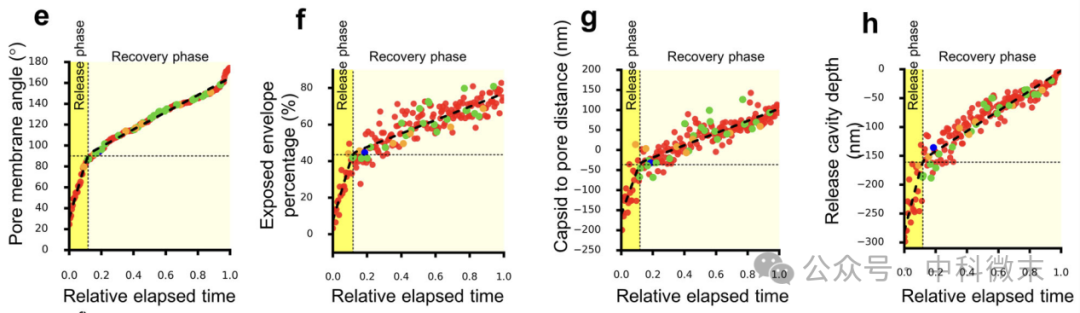
图6:单粒子胞外作用各参数与相对经历时间的函数的散点图
团队推测,驱动病毒囊泡胞吐的动力可能有三方面:
高能的融合前状态和低能的融合后状态的能量差;
融合的囊泡与质膜之间的膜张力;
囊泡膜变平坦的平坦化能量;
其中,前两者主要驱动第一个过程,尤其是第一个能量差,提供快速的能量来源;当能量差耗尽后,将进入缓慢的第二阶段。
病毒的“小助手”
有趣的是,团队还发现,有些囊泡在释放病毒颗粒后,还会形成“网格状”结构,即网格蛋白包被的凹陷(clathrin-coated pit,CCP),每个凹陷坑都被特征的五边形和六边形密度覆盖(图7a-c)。这种结构可能通过减少囊膜和包膜之间的接触面积,来促进单颗粒胞吐,也可能提供额外的能量来驱动病毒胞吐,从而加速病毒的释放。
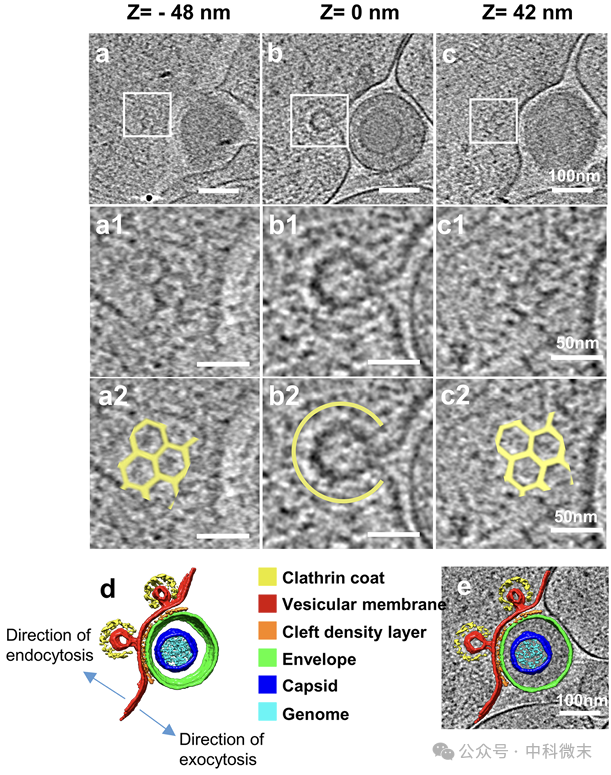
图7:病毒胞吐CCP,病毒中央平面(b)的下方(a)和上方(c)的断层图的多边形密度
同时,共享着相似的结构,也提示着病毒胞吐和细胞突触胞吐不仅具有保守的融合蛋白机制,而且可能共享驱动膜动力学的共同生物物理机制。
病毒的“逃生之路”
前文提到病毒感染神经元后不仅产生病毒颗粒,也产生L-颗粒。用同样的方法观察L-颗粒,发现L-颗粒同样有两相和CCP结构,不同的是其L-颗粒释放相的时间较长,且速度较慢。
双相胞吐的发现为更好地表征各种细胞胞吐事件提供了一种方法:比如可将释放速度与恢复速度之比,定义为胞吐系数,用来表征不同类型的胞吐,并能反映囊泡释放的效率。感染性病毒颗粒的胞吐系数大于非感染性L-颗粒的胞吐系数,这可能是由于它们的囊膜组成和内部内容的不同(缺乏衣壳会降低L-颗粒囊膜的刚性,从而导致释放L-颗粒的囊泡膜张力降低)。较大的系数可能有助于病毒颗粒(而不是L-颗粒)逃离宿主的免疫防御,从而感染新的宿主进行病毒传播。
除了胞吐之外,膜融合还发生在包膜病毒的进入过程中。结合其他文献报道,独特的释放和恢复阶段的存在可能是单纯疱疹病毒进入和退出过程中的一个保守特征,甚至可能是其他涉及膜融合的事件的共同特征,未来还需要更多地探索。
在研究病毒通过神经元囊泡胞吐而释放的过程中,冷冻电镜技术发挥了无可替代的关键作用。这项技术使我们能够可视化胞吐过程并理解其时间进程,进而可推测其背后的能量来源和动力机制,包括一个快速“释放阶段”,由融合蛋白和融合的膜驱动,和一个缓慢“恢复阶段”,由弯曲膜的展平驱动。结构还显示细胞外排的双相特性似乎对于病毒进入过程中的膜融合是保守的,并推测其他膜融合事件应具有通用性。冷冻电镜作为结构生物学领域的一颗璀璨明珠,其技术的蓬勃发展极大地推动了我们对病毒、细胞等结构的深入认识。它不仅使结构解析变得更加高效和精确,还促进了生物学、物理学、化学以及计算机科学等多个学科的交叉融合,共同探索生命的奥秘。
中科微末作为国内结构生物学与人工智能技术的探索者,已充分认识到提供优质结构解析服务对于生命科学研究的重要意义。中科微末依托自主研发的冷冻电镜技术,专注提供结构生物学研究服务,实现目标蛋白原子级高分辨率的结构解析。中科微末团队在冷冻电镜技术方面积累了大量算法与专利,可提供“高难度结构解析有解决方案,低难度结构解析更迅速、价格更优惠”的技术服务。展望未来,中科微末将继续致力于冷冻电镜技术的研发和创新,持续推出更多切合客户需求的结构解析解决方案。
欢迎加入交流群
我们开通了互相学习分享交流的平台

欢迎扫码加群,注明意图
(如:投稿、合作等)
首先非常感谢各位专家、老师、领导们关注与支持。
在此,我们开通了与大家一起分享交流的群平台,希望能够得到更多专业老师的指导,指正不足,分享自己的科研成果等。同时,欢迎各个科研院所、医药等企业来与我们建立商务合作等。
最后,感恩遇见!感谢有您一路相伴!
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流

