index_new5.html
../../../zaker_core/zaker_tpl_static/wap/tpl_guoji1.html
![]()
AlphaProteo是Google DeepMind推出的人工智能系统,能设计新型高强度蛋白质粘合剂,加速生物和健康研究,虽有局限性但前景广阔。
🧪AlphaProteo以蛋白质数据库和AlphaFold的大量数据为基础训练,掌握分子相互结合方式,给定目标分子结构和结合位置,即可生成候选蛋白质。
💪AlphaProteo为多种目标蛋白生成新结合体,在测试的七种目标蛋白质上实现更高实验成功率,结合亲和力是现有最佳方法的3到300倍。
🔬研究团队通过不同实验对AlphaProteo的蛋白质粘合剂进行验证,证实其结合相互作用及生物学功能,同时也指出该系统的局限性及改进方向。
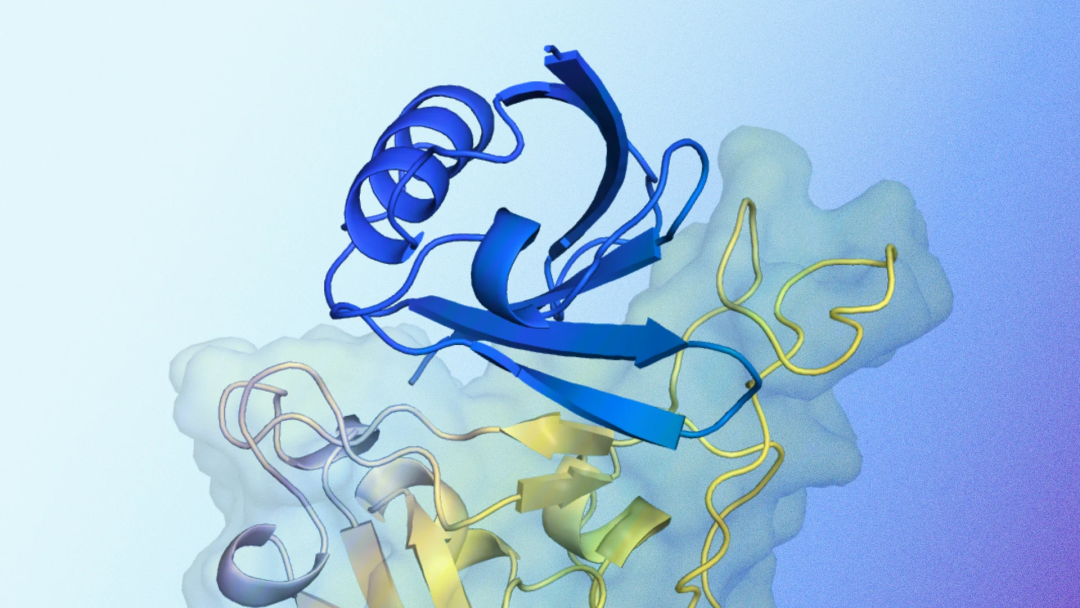
从细胞生长到免疫反应,人体内的每一个生物过程都依赖于被称为蛋白质的分子之间的相互作用。就像使用钥匙开锁一样,一种蛋白质可以与另一种蛋白质结合,帮助调节关键的细胞过程。AlphaFold 等蛋白质结构预测工具已经让我们深入了解了蛋白质如何相互作用以发挥其功能,但这些工具无法创造新的蛋白质来直接操纵这些相互作用。然而,科学家们可以创造出成功与目标分子结合的新型蛋白质。这些结合体可以帮助研究人员加快广泛的研究进展,包括药物开发、细胞和组织成像、疾病认识和诊断,甚至作物对害虫的抗性。虽然最近的蛋白质设计机器学习方法取得了诸多进步,但这一过程仍然需要大量的实验测试,十分费时耗力。日前,Google DeepMind 推出了他们首个用于设计新型高强度蛋白质粘合剂的人工智能系统——AlphaProteo,作为生物和健康研究的基础。这项技术有可能加速人类对生物过程的理解,帮助发现新药、开发生物传感器等。AlphaProteo 可以为多种目标蛋白生成新的蛋白结合体,包括与癌症和糖尿病并发症有关的血管内皮生长因子 A。这是人工智能工具首次成功设计出血管内皮生长因子 A 的蛋白质粘合剂。在测试的七种目标蛋白质上,AlphaProteo 还实现了更高的实验成功率,其结合亲和力是现有最佳方法的 3 到 300 倍。https://storage.googleapis.com/deepmind-media/DeepMind.com/Blog/alphaproteo-generates-novel-proteins-for-biology-and-health-research/AlphaProteo2024.pdf能与目标蛋白质紧密结合的蛋白质粘合剂很难设计。传统方法耗时长,需要多轮大量的实验室工作。粘合剂制成后,还需要经过多轮实验来优化粘合亲和力,使其结合得足够紧密,从而发挥作用。AlphaProteo 以蛋白质数据库(PDB)中的大量蛋白质数据和 AlphaFold 中的 1 亿多个预测结构为基础进行训练,掌握了无数分子相互结合的方式。只需给定目标分子的结构和该分子上的一组首选结合位置,AlphaProteo 就会生成能在这些位置与目标分子结合的候选蛋白质。视频|预测的蛋白质结合体结构与目标蛋白质相互作用的示意图。蓝色显示的是 AlphaProteo 生成的预测蛋白质结合结构,黄色显示的是目标蛋白质。
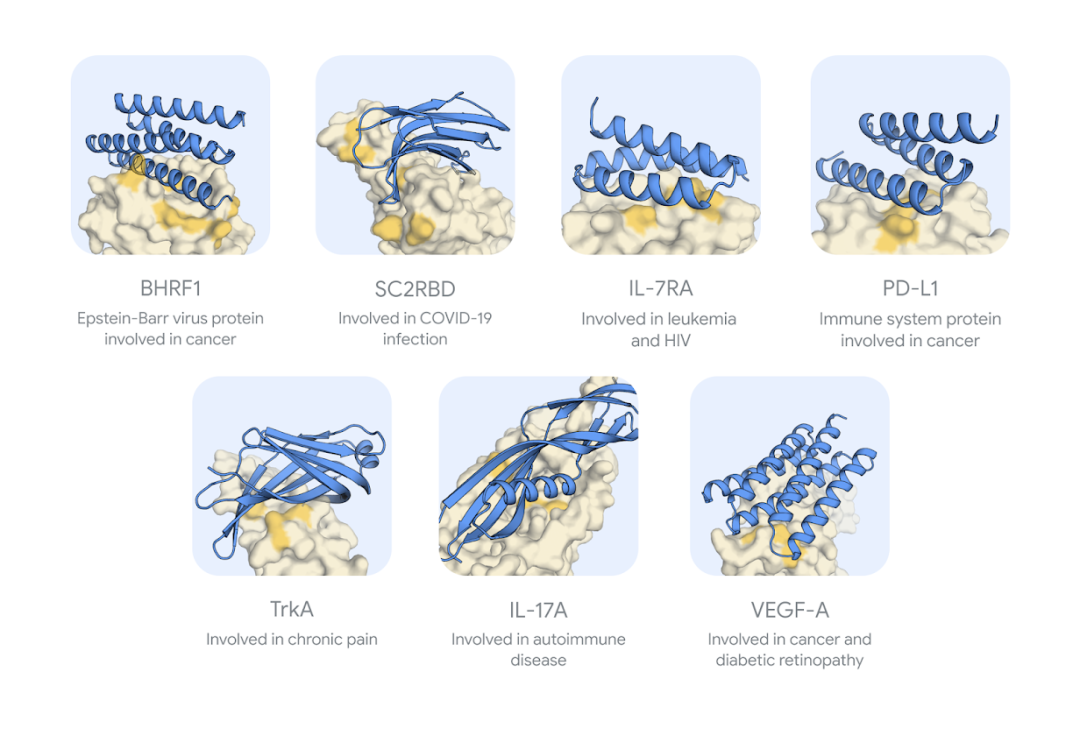
为了测试 AlphaProteo,研究团队为不同的目标蛋白质设计了粘合剂。这一系统具有高度竞争性的结合成功率和同类最佳的结合强度。对于七个靶点,AlphaProteo 在实验室中生成了候选蛋白,在实验测试中,这些候选蛋白与目标蛋白的结合强度很高。图|AlphaProteo 成功生成粘合剂的七个目标蛋白质的预测结构图示网格。蓝色显示的是在湿实验室测试的粘合剂实例,黄色显示的是蛋白质目标,深黄色突出显示的是预期结合区域。
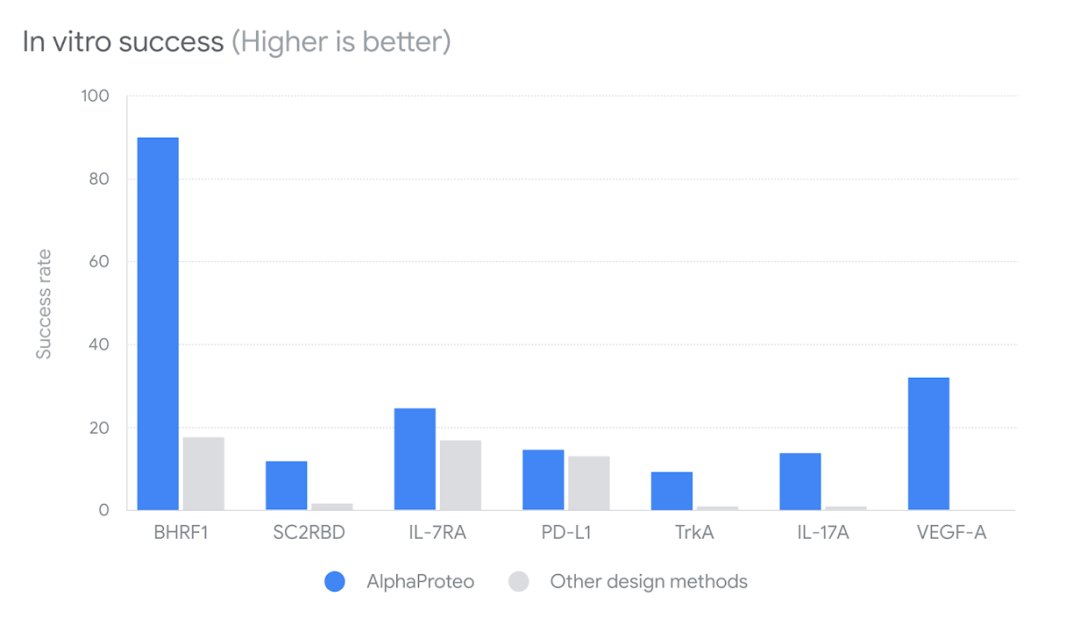
对于病毒蛋白 BHRF1 这一特定靶标,在湿实验室进行测试时,88% 的候选分子都成功结合。根据测试的目标,AlphaProteo 粘合剂的结合强度平均比现有最佳设计方法高出 10 倍。对于另一个靶点--TrkA,他们的粘合剂甚至强于先前针对该靶点设计的、经过多轮实验优化的最佳粘合剂。图|条形图显示了与其他设计方法相比,AlphaProteo 对七种目标蛋白质的体外实验成功率。更高的成功率意味着必须测试更少的设计才能找到成功的结合体。
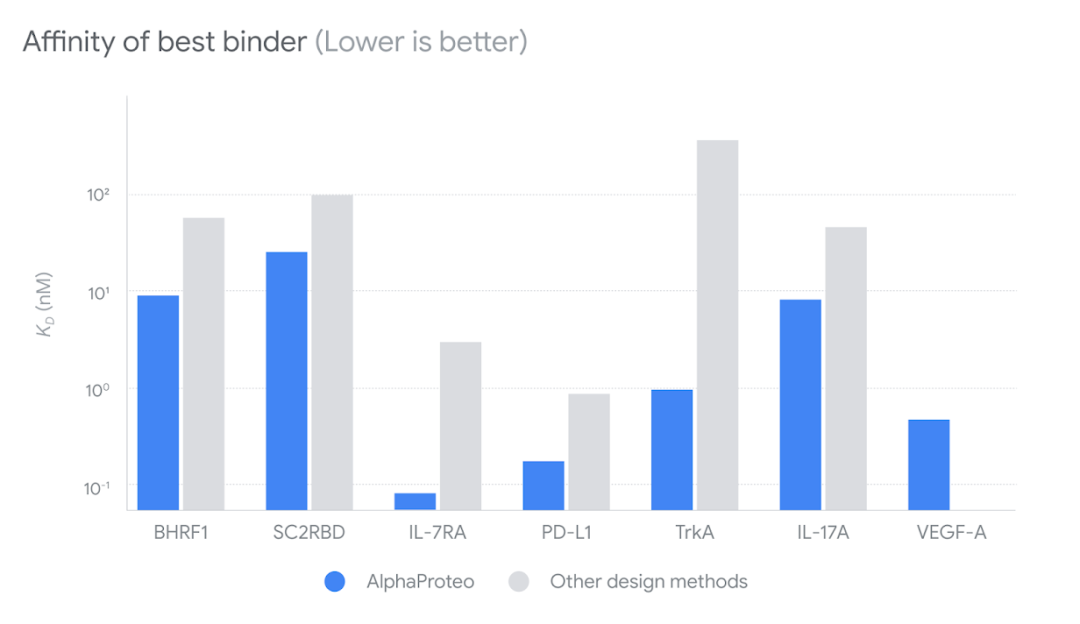
图|条形图显示了 AlphaProteo 在未进行实验优化的情况下,与其他设计方法相比,对七种目标蛋白的最佳亲和力。亲和力越低,说明结合蛋白与目标蛋白结合得越紧密。除了在湿法实验室进行硅学验证和测试 AlphaProteo 外,他们还与弗朗西斯-克里克研究所的 Peter Cherepanov、Katie Bentley 和 David LV Bauer 研究小组合作,对他们的蛋白质粘合剂进行验证。通过不同的实验,他们深入研究了一些较强的 SC2RBD 和 VEGF-A 结合蛋白。他们证实,这些粘合剂的结合相互作用确实与 AlphaProteo 预测的相似。此外,他们还证实了这些粘合剂具备有用的生物学功能。AlphaProteo 的性能表明,它可以大大缩短涉及广泛应用的蛋白质粘合剂的初始实验所需的时间。不过,这一人工智能系统也有局限性,它无法成功设计出针对第 8 个靶标 TNFɑ 的粘合剂,TNFɑ 是一种与类风湿性关节炎等自身免疫性疾病相关的蛋白质。他们选择 TNFɑ 来挑战 AlphaProteo,因为计算分析表明,要设计出针对 TNFɑ 的粘合剂极其困难。他们将继续改进和扩展 AlphaProteo 的功能,从而最终解决此类挑战目标。此外,实现强结合通常只是设计可用于实际应用的蛋白质的第一步,在研发过程中还有许多生物工程障碍需要克服。