近年来研究发现cGAS-STING通路的异常激活参与了多种炎症性疾病的发生发展 [1,2]。因此,开发靶向抑制cGAS-STING通路的药物具有广阔的临床应用前景。cGAS-STING通路中STING蛋白的激活是一个多步骤的过程,包括其与内源性配体cGAMP的结合、自我寡聚化、以及从内质网到高尔基体的易位。已有研究证实,破坏这些步骤中的任何一个环节都可以有效抑制STING的激活。传统的基于结构的药物筛选方法通常聚焦于STING蛋白上的特定结合位点。
近日,中国科学院上海药物研究所郑明月团队采用前期开发的基于蛋白质一级序列且不依赖于结合位点的TransformerCPI模型 [3,4]来识别能够与STING蛋白结合的化合物。其中,来源于中药甘草的天然产物甘草查尔酮D(Licochalcone D,LicoD)被鉴定为一种有效且具有选择性的STING抑制剂。作用机制上,LicoD不与经典的STING配体结合口袋结合,而是通过共价修饰STING的Cys148残基来抑制STING的寡聚化,从而抑制STING及下游信号通路的激活。体内药效学实验结果显示,LicoD可以有效改善Trex1缺失引起的小鼠自身炎症性疾病表型。总的来说,本研究在一定程度上揭示了甘草治疗炎症性疾病的现代药理作用机制,同时也展示了TransformerCPI模型在发现常规结合口袋之外的变构化合物方面的实用性。该研究成果于2024年8月22日在SCIENCE CHINA Life Sciences在线发表,题为“Targeting STING oligomerization with licochalcone D ameliorates STING-driven inflammatory diseases”。

背景
cGAS-STING通路是感知细胞质中dsDNA的关键信号通路,cGAS与dsDNA结合后,生成第二信使cGAMP。cGAMP结合并激活STING,从而诱导Ⅰ型干扰素和促炎细胞因子的产生,最终启动机体免疫应答。由于cGAS以碱基序列无关的方式与dsDNA结合,因此多种来源的胞浆dsDNA都可以激活cGAS-STING通路。在正常情况下,细胞会利用核酸代谢酶清除异常dsDNA,但是当编码这些酶的基因发生突变或缺失时会导致胞浆dsDNA积累,进而引起cGAS-STING通路的异常激活。携带这些基因缺陷的人群会伴随着严重的炎症性疾病的发生,如Aicardi-Goutières综合症和系统性红斑狼疮等。STING发生功能获得性突变会使STING在不依赖于内源性配体的刺激下而发生自激活,进而引发STING相关婴儿期发病血管病以及家族性冻疮样狼疮等炎症性疾病。此外,负责将蛋白从高尔基体向内质网回收的COPI复合体关键亚基COPA突变后会导致STING在高尔基体中蓄积并持续激活STING下游信号,从而诱发一种名叫COPA综合征的自身炎症性疾病(图1)。因此,开发靶向cGAS或STING的抑制剂具有广阔的临床应用前景。
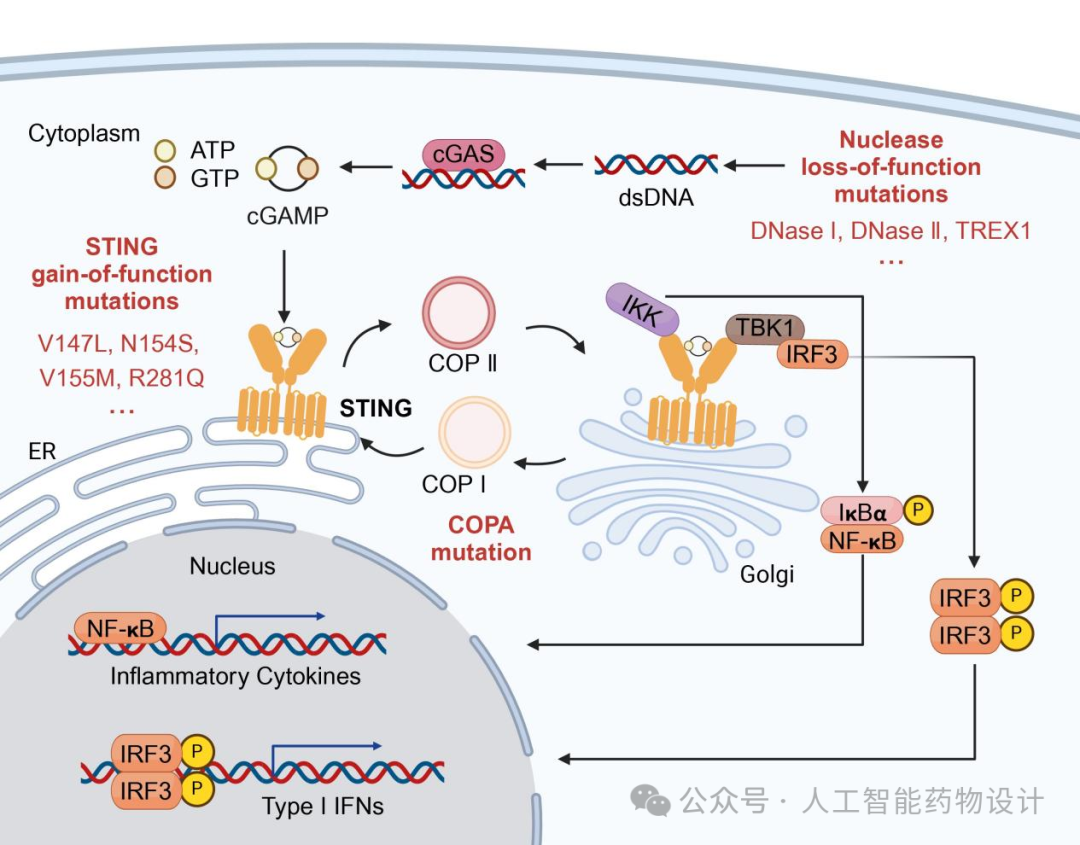
图 1. 基因突变导致cGAS-STING通路异常激活,造成Ⅰ型干扰素和促炎细胞因子过度释放。具体机制主要包括三个方面:一是核酸代谢酶发生功能丧失性突变,导致胞浆DNA异常积累从而持续激活cGAS-STING通路;第二种是STING发生功能获得性突变,导致STING可以不依赖于内源性配体而发生自激活;第三种是COPA发生功能丧失性突变,导致STING在高尔基体中蓄积并持续激活STING下游信号。
目前,STING抑制剂的研发方向主要有靶向配体结合口袋以阻碍内源性配体cGAMP与STING的结合,以及通过抑制STING氨基酸残基Cys88/Cys91处的棕榈酰化来破坏其在高尔基体上的定位来阻止STING的激活等。然而,这些抑制剂尚未取得令人满意的结果,并未进入临床研究。因此,STING抑制剂的开发依然面临重大挑战。STING的配体结合口袋具有高度极性,在配体结合过程中会发生明显的构象变化,这些因素限制了基于对接方法发现STING抑制剂。此外,基于细胞表型发现STING抑制剂既费时又费力,而且难以确保特异性。在本研究中,研究人员利用组内先前开发的基于序列的人工智能虚拟筛选方法并结合湿实验验证,以期能够快速高效鉴定出靶向STING的抑制剂。
结果与讨论
2.1 基于序列的人工智能虚拟筛选方法应用于STING小分子调控剂的发现
研究团队利用基于序列的TransformerCPI模型,预测了STING与20万个化合物(来源于SPECS库以及组内化合物库)之间的潜在相互作用,筛选出排名前1000的化合物并通过聚类分析,得到100个候选化合物(图2A)。随后通过蛋白质热迁移(PTS)实验检测候选化合物与STING蛋白的结合能力,发现天然产物LicoD可以剂量依赖性地增加人源hSTINGH232、hSTINGR232、STING自激活突变体(hSTINGS154和hSTINGM155)以及鼠源mSTING的热稳定性(图2B-D)。此外,表面等离子共振(SPR)与等温滴定量热法(ITC)实验进一步确定了LicoD与STING蛋白具有1-3 µM的直接结合活性(图2E-F)。这些结果表明,天然产物LicoD可以直接与STING蛋白结合。
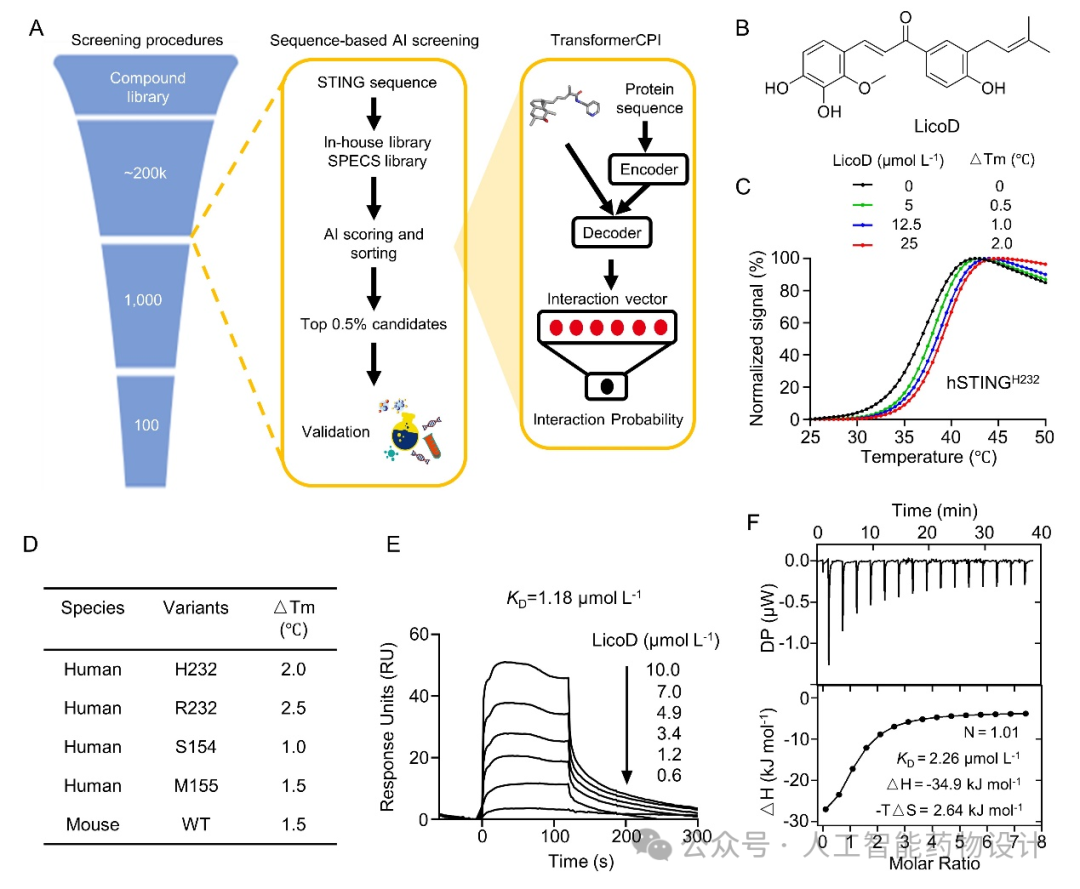
图 2. STING小分子配体的虚拟筛选与实验验证。(A)基于序列的TransformerCPI模型筛选靶向STING的小分子化合物的流程示意图。(B)LicoD的化学结构。(C)不同浓度的LicoD对hSTINGH232热稳定性的影响。(D)LicoD对不同hSTING变体和mSTING蛋白热稳定性的影响。(E)SPR实验检测LicoD与hSTINGH232结合的动力学。(F)ITC实验检测LicoD与hSTINGH232的结合亲和力。
LicoD选择性抑制cGAS-STING信号通路的激活
为了确定LicoD对细胞内cGAS-STING信号通路的影响,研究人员首先检测并发现LicoD对dsDNA刺激的细胞中IFNB1、CXCL10和IL6转录水平均显示出剂量依赖性的抑制效应,并且剂量依赖性地抑制了STING内源性配体cGAMP诱导的STING信号通路的激活(图3A-C)。进一步研究表明LicoD直接作用于cGAS-STING通路中的STING蛋白并选择性抑制cGAS-STING信号通路的激活(图3D-F)。并且LicoD可以明显抑制多种STING激动剂诱导的STING通路中关键蛋白磷酸化水平的升高(图3G)。另外,转录组学实验与差异基因富集分析证实了LicoD对STING介导的信号通路的抑制作用(图3H-I)。这种选择性抑制STING激活的特性,为避免广泛的免疫抑制提供了一种可能,特别是在需要精确调控免疫反应的治疗中显示出潜力。
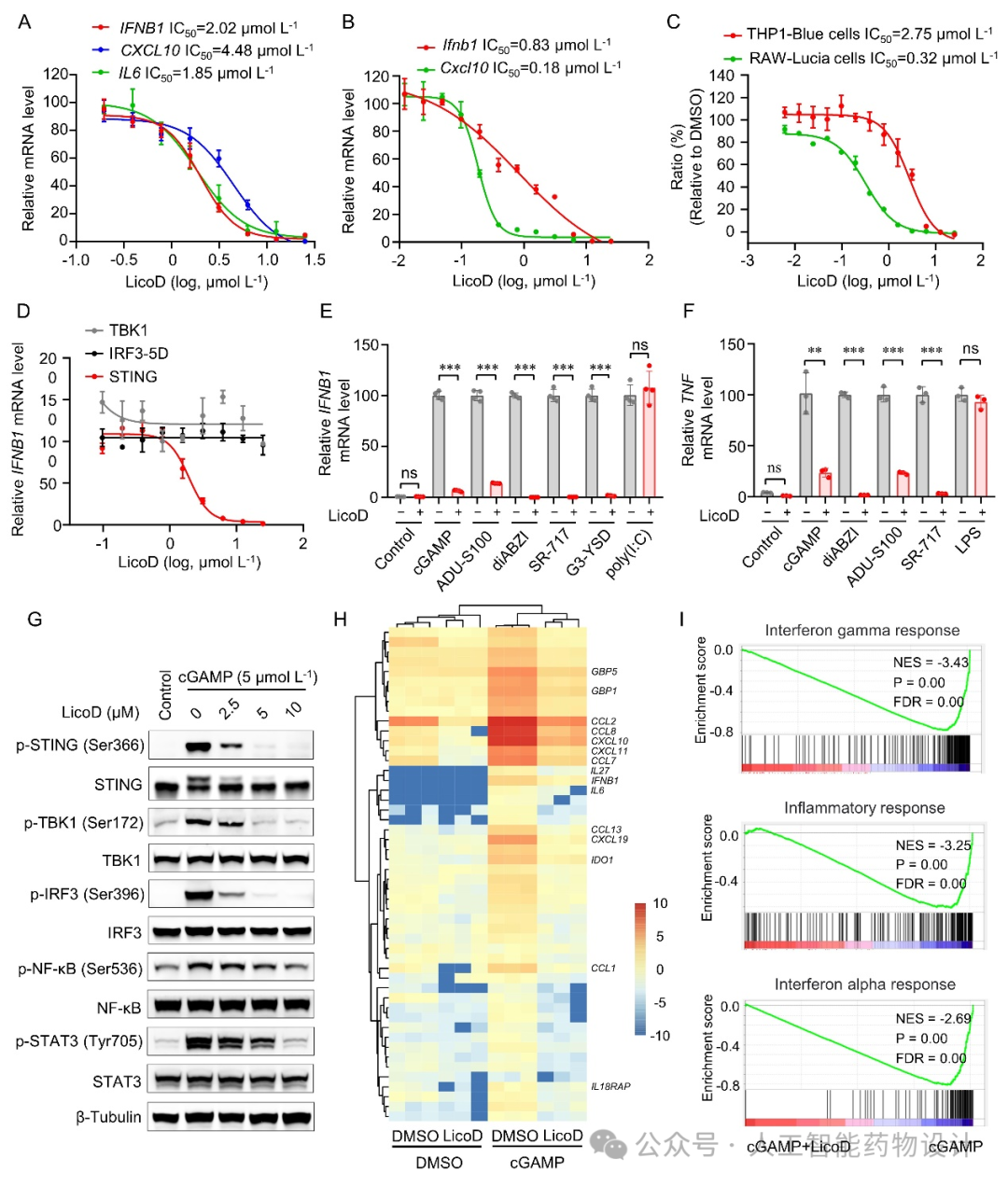
图 3. LicoD选择性抑制cGAS-STING信号通路的激活。(A-B)LicoD浓度依赖性地抑制THP-1来源的巨噬细胞(A)和RAW264.7细胞(B)中dsDNA刺激引起的炎症因子升高。(C)LicoD浓度依赖性地抑制细胞中cGAMP刺激引起的STING下游信号通路的激活。(D)STING、TBK1或IRF3-5D导入293T细胞后用LicoD处理,RT-qPCR检测IFNB1 mRNA水平。(E-F)THP-1来源的巨噬细胞分别用LicoD和cGAMP、ADU-S100、diABZI、SR-717、G3-YSD、poly (I:C)或LPS共处理,后用RT-qPCR检测IFNB1(E)和TNF(F) mRNA水平。(G) THP-1来源的巨噬细胞用LicoD和cGAMP共处理后,用Western Blotting分析细胞中STING及下游关键蛋白的激活水平。(H)RNA测序热图。(I)GSEA富集分析结果。
LicoD通过共价修饰STING的Cys148抑制STING寡聚化
考虑到LicoD对由多种STING激动剂诱导的信号的广谱抑制作用,研究人员推测LicoD可能与这些激动剂竞争性地结合到配体结合口袋,因此建立了一种使用FAM标记的diABZI(一种已报道的STING激动剂)的荧光偏振测定方法。结果显示LicoD不会破坏STING激动剂与配体结合口袋的结合(图4A),表明LicoD没有结合到STING的配体结合口袋。尺寸排阻色谱和Western Blot实验显示LicoD能够显著抑制cGAMP诱导的STING寡聚化(图4B-C)。进一步探究结合位点和作用机制,发现LicoD可以共价结合到STING的Cys148(图4D-E),并破坏了STING与TBK1的相互作用,以及它们在细胞中的共定位(图4F-G),以及抑制了cGAMP诱导的IRF3和NF-κB的核转运(图4H和I)。此外,LicoD还可以抑制STING功能获得性突变S154变体和M155变体的激活(图4J),这表明LicoD在治疗与STING自激活突变相关的疾病方面具有潜力。
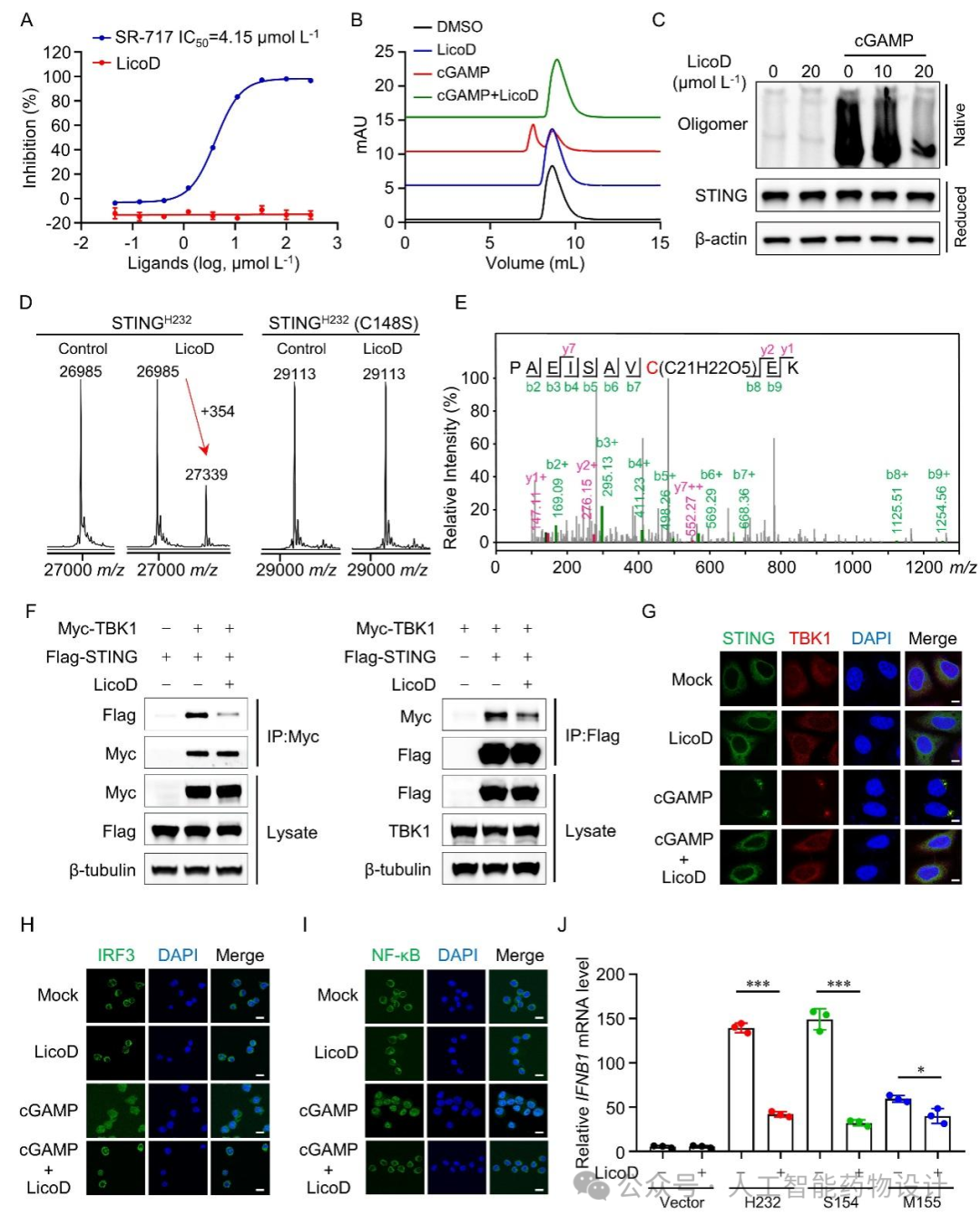
图 4.LicoD通过共价修饰Cys148抑制STING寡聚化。(A)在荧光偏振竞争实验中,LicoD没有取代FAM-diABZI。(B)纯化的hSTINGH232与LicoD、cGAMP或两者同时在4℃下孵育过夜时的尺寸排阻色谱图。(C)用指定浓度的LicoD预处理THP-1来源的巨噬细胞再用cGAMP刺激,Western Blotting分析STING寡聚程度。(D)LicoD与STINGH232和STINGH232(C148S)孵育后的蛋白质谱图。(E)二级质谱显示LicoD可以共价修饰在PAEISAVCEK肽段的半胱氨酸尚。(F)免疫共沉淀法检测LicoD对STING与TBK1相互作用的影响。(G)免疫荧光法检测LicoD对STING和TBK1共定位的影响。(H-I)免疫荧光法检测LicoD对IRF3 (H)和NF-κB(I)入核的影响。(J)相应的hSTING质粒导入293T细胞后用LicoD处理,采用RT-qPCR检测IFNB1 mRNA水平。
LicoD显著改善Trex1缺失小鼠的自身炎症性疾病表型
Trex1缺失小鼠因STING信号通路的持续激活而表现出严重的自身炎症性疾病表型,包括体内高水平的促炎细胞因子的释放和广泛的组织损伤。因此,研究人员采用了Trex1缺失小鼠开展体内药效实验以评估LicoD的体内抗炎作用。首先,在Trex1缺失小鼠的骨髓衍生巨噬细胞(BMDMs)中,LicoD处理显著抑制了I型干扰素和促炎细胞因子的上调(图5B)。在体内药效学实验中,LicoD可以显著抑制Trex1缺失小鼠多种组织中I型干扰素和促炎细胞因子的表达,并改善小鼠心脏、舌头、胃和肌肉的炎症症状(图5C和D)。这些结果表明LicoD显著减轻了Trex1缺失小鼠的自身炎症性疾病表型。
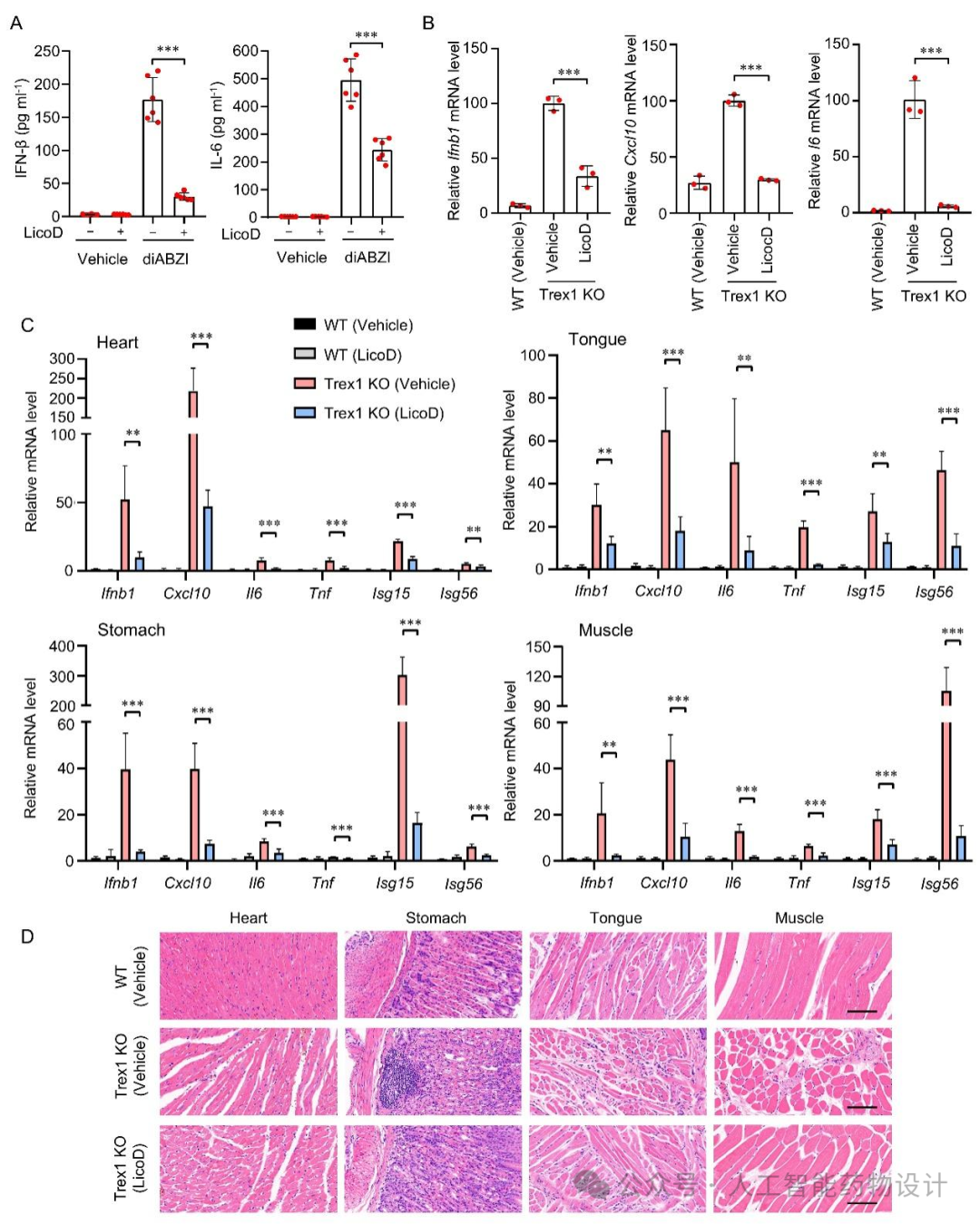
图 5. LicoD显著改善Trex1缺失小鼠的自身炎症性疾病表型。(A)C57BL/6J小鼠腹腔注射LicoD后皮下注射diABZI,检测血清中IFN-β和IL-6的浓度。(B)WT和Trex1缺失小鼠的BMDMs分别用LicoD或DMSO处理,后用RT-qPCR检测Ifnb1、Cxcl10和Il6的mRNA表达水平。(C-D)WT和Trex1缺失小鼠腹腔注射LicoD,持续20天。实验结束后,取小鼠心脏、舌、胃、肌肉组织标本进行炎症因子的mRNA表达测定(C)和H&E染色分析(D)。
结论
在本研究中,研究人员利用基于蛋白质一级序列的TransformerCPI模型来发现能够与STING蛋白结合的化合物。其中,天然产物LicoD被鉴定为一种有效且具有选择性的STING抑制剂。LicoD是从甘草根中提取的关键活性成分,具有明确的抗炎活性。本研究表明,甘草的抗炎功效可能部分归因于LicoD对 STING的抑制。从机制上讲,LicoD不结合在STING的配体结合口袋内,而是在Cys148位共价修饰STING。这种修饰阻碍了STING的寡聚化,从而抑制了 TBK1的募集以及IRF3和NF-κB的核易位。因此,LicoD不仅可以抑制激动剂介导的STING激活,还可以抑制不依赖配体的STING变体的自激活。值得注意的是,Cys148位于STING蛋白柔性连接区,该连接区将配体结合域连接到跨膜域,缺乏明显的口袋,这使得传统的基于结构的筛选方法难以发现LicoD。总的来说,这项研究在一定程度上揭示了甘草治疗炎症性疾病的现代药理作用机制,以及LicoD在治疗STING驱动的炎症性疾病方面的潜力。另外,该研究还展示了TransformerCPI模型在发现正构口袋之外的变构调控剂方面的实用性。
中国科学院上海药物研究所研究生张颖慧、上海药物研究所与南京中医药大学联合培养研究生刘亚丹和姜兵为本文共同第一作者。中国科学院上海药物研究所张素林副研究员、郑明月研究员、以及博士后杨瑞瑞为论文共同通讯作者。本研究得到了国家自然科学基金、国家重点研发计划、中国科学院青年创新促进会会员项目、上海药物研究所与上海中医药大学中医药创新团队联合研究项目、南京大学医药生物技术国家重点实验室开放基金、上海市自然科学基金、以及中国科协青年人才托举工程项目的资助。感谢(上海)国家蛋白质科学中心大规模化蛋白质制备系统工作人员提供的技术支持和帮助。
参考资料
[4]Chen L, Fan Z, Chang J, et al. Sequence-based drug design as a concept in computational drug design. Nat Commun. 2023;14(1):4217.
原文链接
Yinghui Zhang, Yadan Liu, Bing Jiang, et al. Targeting STING oligomerization with licochalcone D ameliorates STING-driven inflammatory diseases. Sci. China Life Sci. (2024). https://doi.org/10.1007/s11427-024-2703-6


