来源:雪球App,作者: 只投BioTech,(https://xueqiu.com/9839602230/297935090)
去年年底,为了收集长期安全性数据,$和铂医药-B(02142)$ 主动撤回了巴托利单抗的上市申请。
在制药行业,因补充临床数据而撤回上市申请是常有的事。不过,由于和铂医药之前给人的期望很高,这次突然的转变确实让一些人感到略微忐忑。
当然,目前看来,这些担忧是多余的。7月18日,据CDE官网,和铂医药重新提交的巴托利单抗用于治疗全身型重症肌无力的申请已被受理。这标志着巴托利单抗的上市进程,已经重新正式启动。

经营企业,难免会遇到小波折。和铂医药也是,有过高峰,也与行业一起经历艰难时刻。但现在,好消息的到来,预示着和铂医药一切都在往好的方向走。
按预期推进
巴托利单抗的主动撤回申请在市场上引发了两方面的疑虑:一是对产品性能的担忧,二是对和铂医药是否能够按计划推进的疑虑。
先来谈谈产品性能,实际上这方面大家不必过于担心。巴托利单抗临床数据显示出非常积极的效果。
例如,今年3月,国际知名的医学期刊JAMA Neurology发表了一项Ⅲ期临床研究结果,充分证实了巴托利单抗在治疗重症肌无力方面的有效性和安全性。
在有效性方面,巴托利单抗的一个显著特点就是快速起效:治疗开始的第2周,巴托利单抗治疗组的MG-ADL评分改善率就与对照组出现了明显差异。
另一个特点是疗效显著且可持续,在第一个治疗周期后,巴托利单抗治疗组的ADL评分持续改善率达到58.2%,而对照组为31.1%,表明巴托利单抗治疗能显著改善患者症状,并具有可持续的治疗效果。
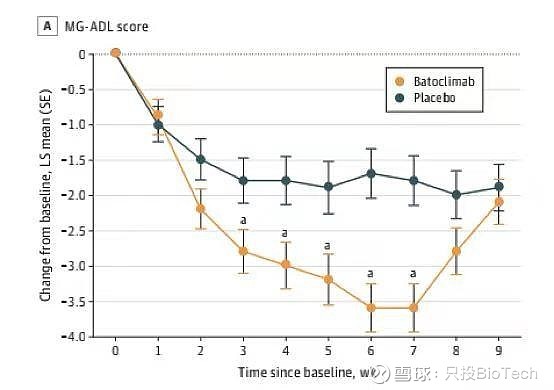
巴托利单抗治疗组患者达到最轻微症状表现(MSE,定义为ADL评分为0或1)的比例为25.4%,远高于对照组的4.7%,这也是巴托利单抗治疗效果显著的一个体现。
此外,在MG定量评分、MG复合评分、15项重症肌无力生活质量评分分析中,巴托利单抗治疗组与对照组也显示出相似的积极趋势,这些额外的证据进一步证实了巴托利单抗治疗效果的可靠性。
在大家关注的安全性方面,巴托利单抗治疗组与对照组治疗后出现的不良事件发生率相近,总体耐受性和安全性数据良好。
这些临床数据不仅消除了对巴托利单抗的疑虑,而且对中国人群的临床应用具有重要的参考价值。
至于进度问题,去年撤回申请时,和铂医药预计2024年上半年会重新向国家药监局提交巴托利单抗的生物制品许可申请。随着上半年的临近,市场上的焦虑情绪也在上升。但和铂医药最终没有让大家失望,于6月27日提交了上市申请。这也表明,在节奏把握方面,和铂医药还是让人比较放心的。
现在,CDE已经正式受理了这个申请,看来巴托利单抗离上市不远了。别忘了,它还拿到了CDE的“突破性治疗认证”,而且这次是第二次审核,如果一切顺利,获批的速度说不定比预期的还要更快。
现金奶牛的孕育
说到现在,巴托利单抗对于和铂医药而言,绝对算是一只看得见的现金奶牛。
咱们先来聊聊它申请的适应症,重症肌无力这个领域,前景非常广阔。
首先得说说患者群体。大家可能认为重症肌无力是个罕见病,患者不多。但实际上,这是一种慢性病,患者数量需要累计计算。在我国,患者规模大约有20万,而且这个数字还在逐渐增长。
再来看现有的治疗手段,局限性不小。虽然目前治疗重症肌无力的药物不少,如胆碱酯酶抑制剂、糖皮质激素,严重时还需使用免疫球蛋白或血浆置换,但这些疗法在安全性和疗效上仍有诸多问题,患者们迫切需要更有效的治疗手段。
从全球范围来看,重症肌无力的治疗发展大致经历了三个阶段:乙酰胆碱受体抑制剂的初步尝试、非靶向免疫抑制剂的应用,以及现在备受期待的靶向免疫治疗。
巴托利单抗正是靶向免疫治疗中的佼佼者。它的治疗机制相当直接,通过与新生儿Fc受体(FcRn)结合,能够降低体内的IgG抗体水平。IgG抗体水平的升高正是导致重症肌无力发展的关键因素,它会破坏神经与肌肉之间的交流,造成肌肉无力。
数据层面,正如上文提及,巴托利单抗几乎具备了慢性病治疗药物所需的所有优点:适用人群广泛、起效快、疗效显著、效果持久、安全性好,竞争力非常强。
在商业化方面,巴托利单抗的推广由石药集团这样的行业资深老炮儿负责,这也让人感到相对放心。因此,和铂医药未来可能无需承担太多成本,就能享受到巴托利单抗带来的稳定现金流。
总结
老实说,行业的波动确实给和铂医药带来了一定的困扰。但看看过去几年,王总带领的团队遇到难关可没选择躺平,而是一直在找办法,变着法儿地求新求变,商业模式啥的都在不断调整。到了2023年,他们还头一遭实现了盈利。
如今,巴托利单抗要是成了稳定的现金奶牛,那和铂医药的安全垫和市场竞争力肯定都会上一个新台阶。综合现在的情况看,在经营上和铂医药可能要再次踏上快车道了。

