文 | 医曜
1996年亚特兰大奥运会开幕式,当拳王阿里颤抖的双手点燃圣火时,全球数亿观众屏息凝视。那双曾挥舞出世界最迅猛拳击的手,此刻却在帕金森病(PD)的侵蚀下无法自控。圣火点燃的瞬间,人类与这种神经退行性疾病的漫长对抗史,也在火光中无声展现。
帕金森病作为神经退行性疾病的“老二”,在中老年人群中肆虐,是威胁中老年人健康的“第三大杀手”,仅次于肿瘤和心脑血管疾病。从最初的震颤被当作衰老,到如今全球超1000万患者的沉重负担,人类在药物研发上投入了半个多世纪,却始终未能找到根治的 “钥匙”。
为何“棘手”的运动障碍疾病,至今仍是医学皇冠上难以摘下的荆棘?
01 帕金森“疑云”
在拳王阿里颤抖地点燃奥运圣火之前,帕金森病早已在人类历史中潜伏了数千年。
古印度医典记载的“Kampavata”、古希腊盖伦手稿中描述的震颤,乃至《黄帝内经》提及的肢体颤动——这些跨越文明的医学观察,最终在1817年被英国医生詹姆斯・帕金森系统归纳。他在《简论震颤麻痹》中描述的六例患者,首次勾勒出这种疾病“静止性震颤、肌肉僵直、运动迟缓和姿势失衡”的四大核心特征。
可是,这篇开创性论文却在半个世纪里少人问津,直到法国神经学之父Charcot重新审视这些症状。他敏锐发现肌强直与运动迟缓的独立性,纠正了“震颤麻痹”的片面命名,并于1877年正式将其冠名为 “帕金森病”。
20世纪初,科学家们开始对帕金森病的病理机制进行深入研究。1912年,德国神经病理学家Fritz Lewy首次在帕金森病患者的大脑中发现了嗜酸性包涵体(后称路易小体);前苏联学者Konstantin Tretiakoff进一步锁定中脑黑质为病变核心区域。
至此,帕金森病的病理拼图逐渐清晰:黑质中密集的多巴胺能神经元大规模死亡,导致输往纹状体的多巴胺锐减,身体便会出现震颤、僵硬、动作迟缓等典型症状。这一发现为后续治疗奠定了基础,也让人们一度认为,补充多巴胺就是治愈帕金森病的“万能钥匙”。
但现实远比想象复杂。随着研究深入,科学家发现“路易小体”并非孤立存在——这种由α-突触核蛋白错误折叠形成的蛋白团块,如同细胞内的“异常信号源”,不仅直接损伤神经元,还会通过神经连接“扩散”至健康细胞,使病变从黑质逐步蔓延至大脑皮层、海马体等区域。这意味着帕金森病已超越单纯的“运动调节系统故障”,演变为一场全身性的神经损伤。
更棘手的是,帕金森病的发病并非单一因素导致,而是遗传与环境交织的结果。约10%的患者携带明确致病基因突变:LRRK2基因突变可导致激酶活性异常增高,引发蛋白质合成失控;GBA基因突变则干扰溶酶体功能,使α-突触核蛋白清除效率下降。但剩下 90% 的散发性患者中,环境因素的作用更为显著:长期接触农药(如百草枯)、重金属(如锰),或有头部外伤史、长期睡眠障碍,都会增加患病风险。
多重打击下,人体代偿机制悄然启动。当黑质多巴胺能神经元死亡超过70%,纹状体多巴胺浓度降至临界点,患者才会出现手抖等明显症状,此时神经损伤早已积重难返。
这种隐匿进展使帕金森病成为老龄化社会的沉默威胁:我国65岁以上人群患病率达1.7%,80岁以上超4%,总患者数突破300万,占全球近半数。更令人忧心的是,这些数字还在随着人口老龄化不断攀升,有预测显示,到 2040年,全球帕金森病患者可能突破1700万。
从詹姆斯・帕金森观察街边老人的震颤,到如今千万患者的困境,人类对这种疾病的认知虽已跨越两个世纪,却仍未触及核心。其复杂的致病机制注定了这场对抗不会是简单的 “攻坚战”,而是一场需要破解多重密码的“持久战”。
02 荣光与阴影
詹姆斯・帕金森描述“震颤麻痹”后的一个多世纪中,人类对这种疾病的治疗几乎都停留在“试错”阶段。
19世纪末,医生们尝试用颠茄提取物缓解震颤,这类抗胆碱能药物能平衡大脑中乙酰胆碱与多巴胺的失衡,短暂减轻手抖,却会引发口干、视力模糊甚至认知混乱,对肌肉僵直和运动迟缓收效甚微,始终未能突破对症缓解的局限。
真正的转折点出现在1967年。左旋多巴(L-DOPA)横空出世,作为多巴胺的前体,它能穿透血脑屏障,在黑质神经元中转化为多巴胺,直接弥补神经递质的缺失。临床数据显示,多数患者用药后震颤消失、僵硬缓解,甚至能重新站立行走。这种“起死回生”的效果让左旋多巴迅速成为治疗金标准,也让医学界一度坚信:只要持续补充多巴胺,就能攻克帕金森病。
可是,医学界很快发现,左旋多巴的疗效会随时间缩短:最初一次服药能维持8小时,几年后可能仅能维持2小时,甚至出现 “开关现象”——上一秒还能正常活动,下一秒突然僵住如雕塑。更可怕的是长期服药者陆续出现“异动症”,肢体如提线木偶般不自主扭动,反而比震颤更影响生活。
这些问题的根源,在于左旋多巴只能补充多巴胺,却阻止不了黑质神经元的持续死亡,也就是只能缓解症状无法治愈疾病。当神经元越来越少,大脑对多巴胺的“处理系统”逐渐失灵,药物浓度的微小波动都会引发剧烈的症状波动。
因此,为了延长药物疗效,科学家们开发出一系列辅助药物:MAO-B 抑制剂(如司来吉兰)能减少多巴胺降解,COMT 抑制剂(如恩他卡朋)可延长左旋多巴作用时间,多巴胺受体激动剂(如普拉克索)则试图直接激活多巴胺受体,推迟左旋多巴的使用。
这些药物确实可以优化症状控制,延长药物的疗效,但本质仍是对多巴胺系统的“修修补补”,既不能清除路易小体,也无法阻止α-突触核蛋白的扩散。
这种局限直接体现在药物市场的格局中。如今全球帕金森病药物市场规模已超百亿美元,但销量前三的产品仍是左旋多巴复方制剂、多巴胺受体激动剂和MAO-B抑制剂。这些药物的作用机制,与半个世纪前的左旋多巴并无本质区别。
03 新药研发的困境与微光
帕金森病新药研发的困局,源于其病理机制的复杂性与临床转化的多重壁垒,一度成为药企研发黑洞。
尽管全球现有超百款药物处于临床阶段,但近十年III期失败的案例屡见不鲜:2019年Intec Pharma的缓释左旋多巴药物因未达主要终点致股价暴跌81%,2018年辉瑞甚至因“高失败率”直接退出帕金森赛道。
这种复杂性首先体现在靶点验证的艰难上。帕金森病的病理机制复杂且相互关联:α-突触核蛋白的错误折叠与扩散、线粒体功能障碍、神经炎症反应、溶酶体清除能力下降……这些机制互为因果,形成恶性循环。过去三十年数十种神经保护剂在临床试验中折戟,关键原因就在于单一靶点干预如同杯水车薪。
“血脑屏障”如同难以逾越的高墙,阻挡了98%以上的小分子药物和几乎所有大分子药物进入脑组织。传统药物设计中,为穿透血脑屏障而增加脂溶性,往往导致水溶性骤降,使药物无法在血液中有效传输。更严峻的是,药物进入脑组织后的浓度难以直接测量,其药效与临床终点的关联如同黑箱。

临床前模型的局限性进一步放大了研发风险。动物模型能模拟部分运动症状,却无法复现人类疾病中α-突触核蛋白的“扩散”,更难模拟认知衰退等非运动症状的进展。这导致许多在动物实验中表现优异的药物,进入人体试验后便黯然失色。有统计显示,帕金森病新药从临床前到最终获批的成功率不足 5%,远低于其他疾病领域。
尽管挑战重重,可全球研发管线仍在缓慢推进。
在生物药领域,α-突触核蛋白作为帕金森病领域最有希望的靶点,已有多款抗体药物进入II期临床,2022年赛诺菲以7500万首付以及9.85亿美元里程碑从韩国公司ABL Bio收购的ABL301就是一款α-Syn/IGF1R双抗。在小分子领域,针对 LRRK2 激酶的抑制剂备受关注,这类药物能抑制突变基因引发的过度激酶活性,在携带 LRRK2 突变的患者亚群中显示出延缓神经元损伤的潜力,渤健与Denali Therapeutics的BIIB122已启动III期试验。
更前沿的疗法聚焦于“源头干预”,通过重编程或替代受损的神经系统元件,从根本上改变疾病进程。基因疗法通常利用病毒载体将治疗基因送入大脑细胞,以提高多巴胺合成或释放神经营养因子,例如AskBio/拜耳的AB-1005、渤健/Ionis的BIIB094等;细胞疗法则试图补充新的多巴胺能神经元以取代病变细胞,例如BlueRock/拜耳的Bemdaneprocel 、Aspen的ANPD001、睿健医药的NouvNeu-01等。
国内研发虽起步较晚,但正以差异化路径寻求突破。上海纽赛尔生物的自体iPSC源多巴胺神经元产品UX-DA001,2024年底获国家药监局临床批件,为中国首个、全球第二个iPSC帕金森细胞疗法;恒瑞医药的新型长效左旋多巴制剂HRG-2010,借助缓释技术平稳药效,正开展III期研究改善晚期患者“关期”波动;绿叶制药全球首创的罗替戈汀缓释微球注射剂,2020年中国获批,每日一次皮下给药替代传统贴片,减少用药不便。另有多家单位探索黄芩酮、藜芦生物碱等中医药来源创新,丰富研发管线。
与此同时,提前诊断与早期干预是突破治疗困局的关键。患者出现手部震颤时,黑质多巴胺能神经元已凋亡超70%,此时药物干预如同在废墟上修危楼。
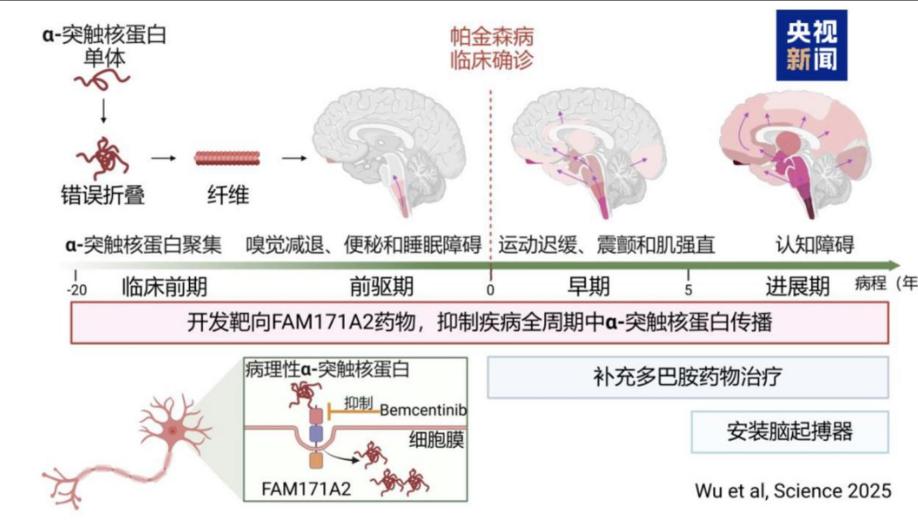
图:帕金森病进程,来源:国金证券
近年发现,肠道菌群紊乱、快速眼动睡眠行为障碍(RBD)等前驱期标志物,可提前10-20年预警。德国基尔大学团队通过血液α-突触核蛋白种子扩增试验,能在确诊前1-10年检测到异常,打开超早期干预窗口。将干预时机从“震颤发生后”提前至“病理启动时”,将彻底重塑帕金森病治疗逻辑。
帕金森病药物研发的困境,本质是人类对大脑复杂性认知的局限。从靶点发现到临床转化,每一步都需跨越科学、技术与伦理的鸿沟。随着AI赋能的多学科协作逐渐瓦解机制迷雾,当基因编辑与细胞疗法重塑神经修复的可能,那把根治帕金森病的“钥匙”,或将在荆棘中浮现。
更多精彩内容,关注钛媒体微信号(ID:taimeiti),或者下载钛媒体App

