2025年5月15日,Nature Reviews Drug Discovery上发表文章Is the FDA’s plan to phase out animal toxicity testing realistic,文中Emulate的首席科学官Lorna Ewart讨论了器官芯片面临的新机遇和主要挑战。
现任领先器官芯片公司Emulate的首席科学官Lorna Ewart长期以来一直对动物和人类毒性数据之间的不匹配感到沮丧。大鼠和狗的临床前研究常常表明药物是安全的,但临床试验数据却会亮起红灯。2012年,在器官芯片技术的早期阶段,她向阿斯利康(AstraZeneca)的同事们提出了一个项目,旨在评估一个模拟肝脏的工程系统是否能更好地解释跨物种安全性数据并找出真正的毒性问题。“起初我被笑着赶出了会议室,”Ewart开玩笑说。又花了12个月才真正获得项目进展和内部资金。
此后情况发生了变化。今年4月,FDA宣布计划逐步淘汰用于接近临床阶段的新候选药物的动物测试。目标首先是彻底改革单克隆抗体的毒性测试,但其他模式也在议程上。美国监管机构正在接纳器官芯片、类器官以及一系列计算机模拟和计算工具,目标是在未来3-5年内使动物研究成为临床前安全/毒性测试中的“例外而非常规”。
几周后,美国国立卫生研究院(NIH)也表示将降低动物模型在生物医学研究中的优先级。

Ewart对这些举措感到兴奋。
她解释说,毒理学界在器官芯片方面取得了巨大进步。Emulate在2022年报告称,其Liver-Chip可以检测到许多动物测试遗漏的肝毒性信号。Ewart及其同事当时计算得出,仅Liver-Chip作为动物测试的辅助手段,就可以为生物制药行业节省30亿美元的研发生产力。当考虑到其他器官芯片系统时,节省的费用膨胀至240亿美元。
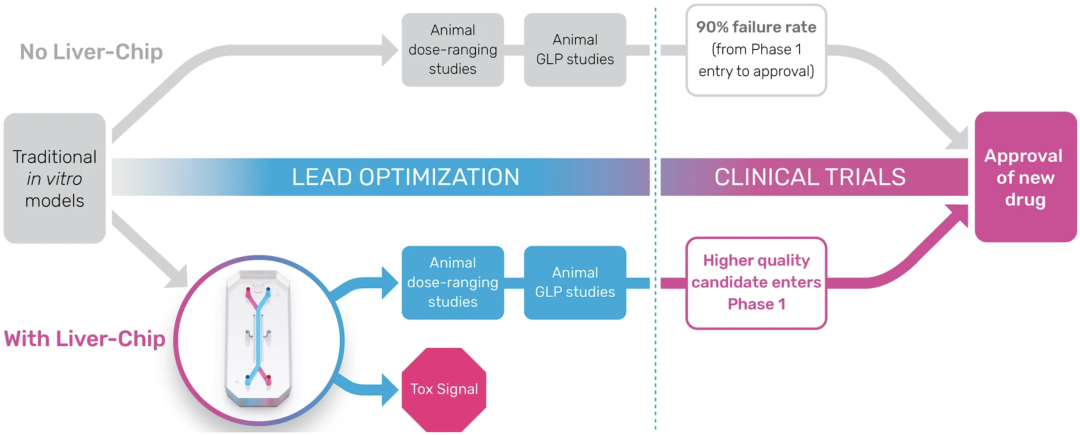
图1 肝脏芯片在典型制药临床前工作流程中的拟议定位
但Ewart补充说,许多其他芯片模型仍需要为毒理学测试进行开发、表征和验证。药物开发者正在接受这种方法,但并非在所有项目中都采用。监管机构仍然需要对这些工具进行资格认定。只有这样,业界才能努力全面实施这些技术,在仍需动物测试的地方与动物测试一起使用,以构建全面的安全性数据包。
“有大量的工作要做,但前方也有巨大的机遇,”Ewart说。
问:你对FDA逐步淘汰动物毒性研究的计划有何反应?
Ewart:首先,我真的很高兴看到它。监管机构的接受度是我每天都会遇到的障碍。我与许多不同的制药科学家交谈过,他们说:“我们喜欢你正在做的事情,但我们不太确定如何使用它。这些数据意味着什么?更重要的是,如果我把它放入IND(新药临床试验)申请中,是否会减慢我的申请审查速度?”
我理解他们的观点,因为我曾经坐在桌子的另一边。因此,我非常高兴这项声明是一个具体的进步。
别忘了,这项声明是在大量倡导和先前工作的基础上发布的。2022年由拜登总统签署的《FDA现代化法案2.0》,该法案将要求从“临床前”改为“非临床”,以允许更多地使用与人类相关的技术。这是FDA强调其对替代方法兴趣并鼓励申办者提交来自器官芯片、类器官和计算机模型数据的一种方式,尽管由于这些工具尚未获得资格认定,尚不清楚它们是否可用于IND决策领域。于是有了FDA的ISTAND试点项目,该项目旨在支持新型药物发现工具的资格认定。Emulate正处于ISTAND项目的第二阶段,旨在为其Liver-Chip获得用于识别某些候选药物药物性肝损伤的资格认定。这些都是好的举措,但它们从未涉及完全替代动物。
但我也对路线图的胆略感到惊讶,因为它极具雄心。然而,不涉及政治,我要说我坚信,要带来改变,你必须全身心投入并制造一点积极的颠覆。
问:在3-5年内逐步淘汰动物模型的目标现实吗?
Ewart:有可能。
目前的指导方针规定申办方应在小型和大型动物中进行安全性和毒性测试。我亲眼目睹过多个项目在这两种动物之间读出差异,这会导致问题。关键问题是,哪一种能预测人体反应?第二种动物是否能识别出第一种动物未发现的毒性信号?
因此,在3-5年内,监管规范可能从要求两种动物变为一种。然后我们仍然有这个工具箱的概念,这种广泛的风险评估策略,但你已经可能淘汰了一种动物模型。
我对这个目标感到兴奋,我喜欢快速推进。但毒理学家中有很大一部分人发出了警告。毒理学协会(Society of Toxicology)刚刚发布声明,表示他们对此事推进的速度感到担忧。
问:最初的重点是单克隆抗体,你怎么看?
Ewart:我认为这是一个明智的起点。
我无法确切知晓路线图的起源,但我怀疑这个决定是多因素促成的,因为单克隆抗体测试依赖非人灵长类动物作为第二种动物。
首先,论证中有科学层面的因素。并非所有人类抗原在灵长类动物中都是保守的,结合亲和力可能不同,在某些情况下目标甚至不存在。在这种情况下,你可以针对动物抗原产生抗体同源物,但你仍然没有使用实际的抗原,免疫原性仍然是一个挑战。我们为何一直采取这条路线是值得商榷的。
其次,灵长类动物研究的财务成本非常高,从研究设计到执行可能需要长达36个月。因此,可能推动采用一种更具人类相关性、成本效益更高且可能更快读出安全性的方法。
最后还有伦理方面的考虑。中国曾是向美国出口非人灵长类动物的主要国家,但在COVID期间停止了。像柬埔寨这样的国家看到了机会并开始运送灵长类动物,但遗憾的是他们是从野外捕捉灵长类动物,并且不懂得如何适当地运输它们。结果,许多灵长类动物在抵达美国海岸时已经死亡。
然而,FDA新方法的问题在于,单克隆抗体的大多数毒性是免疫介导的。一方面,放弃动物是有道理的,因为动物的免疫系统与人类免疫系统的行为不同。但我认为,要建立良好、具有免疫能力的体外人类相关模型,仍然需要大量的研发工作。
问:小分子方面呢?
Ewart:对于小分子毒性,大约有8-10个器官经常出现剂量限制性毒性。因此,如果有人试图在未来3-5年内构建、评估、验证和认定这些器官的模型并开始使用它们,那将使人更有信心合理地减少动物使用。
问:你和同事花了7年时间开发和发表你们的Liver-Chip。让其他模型达到同等水平需要多长时间?
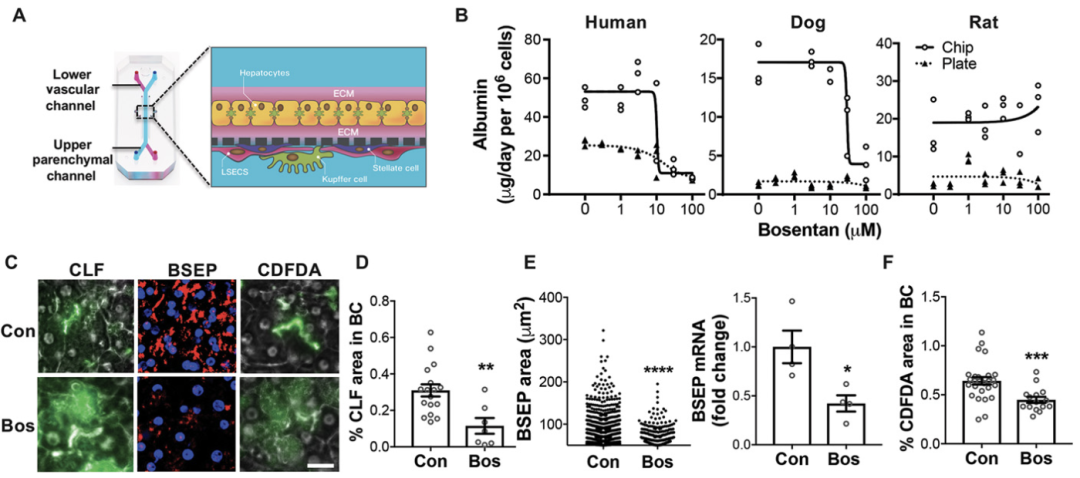
图2 大鼠、狗和人类肝芯片中物种特异性药物毒性的概述
Ewart:那个项目的难点在于开发狗肝脏芯片,特别是获取新鲜的狗肝细胞。这延长了时间线。如今,让一个模型启动并运行大约需要18-24个月,然后你才会开始验证和资格认定。
心脏和大脑是另外两个主要的毒性靶器官。有一些非常好的“心脏芯片”,其敏感性和特异性程度与我们报道的Liver-Chip相似。在神经模型方面,人们对微型大脑(实质上是神经类器官)非常感兴趣。
我的一个希望是,通过这些声明,监管界可以开始解决一些阻碍资格认定进程的悬而未决的问题。例如,当我们向ISTAND提交Liver-Chip以获得FDA资格认定时,我们花了相当长的时间来撰写意向书。如果有一个我们可以遵循的模板,就可以消除这些时间浪费,团队可以专注于科学研究。
FDA已经谈到要启动一系列研讨会,NIH也创建了一个研究、创新、验证和应用办公室(Office of Research, Innovation, Validation, and Application)。我认为这也会有所帮助。
问:NIH的推动将要求模型也能用于有效性测试。用于有效性测试的芯片开发考量与用于毒理学的有何不同?
Ewart:目前,大多数毒理学测试仍在所谓的健康模型系统中进行。我们在Liver-Chip中使用的所有细胞都来自符合严格标准的供体--不饮酒、不吸烟、不使用非法药物等。
随着在毒理学测试中使用疾病特异性模型的积极讨论,这种情况正在开始改变。辉瑞公司最近因其GLP-1拮抗剂danuglipron导致肝酶升高而暂停了I期试验。虽然没有公开信息表明受影响的参与者患有脂肪肝疾病,但至少70%的肥胖个体肝脏中有一些脂肪堆积,而这是已知的更容易发生毒性的风险因素。
但是当你为有效性研究构建疾病模型时,它极具挑战性的部分原因在于疾病从未有共识。疾病极其复杂且具有异质性。以脂肪肝为例,我可以通过给肝细胞添加额外的果糖来制作一个脂肪肝模型,这完全可以接受。但其他人可能会说我需要在其中加入脂肪酸。为了说明这一点,目前有超过10种不同的脂肪肝小鼠模型。在动物模型上并不存在共识。
作为药理学家,我会说当你为有效性构建模型时,你必须选择你关注的维度(axis)并对其进行充分表征。不要试图成为一个面面俱到的全能模型。
这正是你需要基础生物学的地方,这也是我认为NIH未来资金可以投入的方向。
问:是否有足够的资金来完成所需的模型开发?
Ewart:资金是一个大问题。
自FDA宣布计划以来,我还没有看到资金状况有任何转变。当然,许多美国学者担心NIH正在缩减预算,因此资金来源确实存在一个合理的问号。
我希望看到资金被用于资助像我们为Liver-Chip所做的那类研究。我们没有获得任何拨款资助。作为一家小公司,这是一笔巨额投资,我非常感谢我们的投资者批准了这笔支出。并非所有公司都能做到这一点。
如果我们想让那3-5年的时间表成为现实,我们必须投入一些资金,因为芯片开发者通常是从大学衍生公司起步的。
我们还需要投入更多资金来培养未来的科学家。生物工程领域还很年轻,因此我们需要培养跨学科的科学家,他们既懂生物学又具备工程思维,反之亦然。这是两种相当不同的技能组合。
问:虽然FDA和NIH都宣布了雄心勃勃的计划来改革非临床测试,但这两个组织也正受困于裁员、重组和资金削减。你预计这会如何发展?
Ewart:我不在这两个组织内,因此无法直接评论。
从领导力的角度来看,建立并维持高绩效团队始终至关重要。如果最近的变革是出于提高效率的愿望,我可能会以略微不同的方式处理这种情况。我担心的是,由于这些变化,一些极其有才华和经验丰富的人可能将不再成为这两个组织未来的一部分。
我认为另一个担忧,跳出美国范围,是世界其他地区将如何回应此事?
最近,英国议会就医学研究中使用狗的问题进行了辩论。看起来短期内这里不会有任何改变,这令人遗憾。欧盟表示要到2026年才会就医学研究中的动物使用问题提出立场。
反方观点认为,只要美国保持约占48%的制药市场份额,它就将始终引领监管方向。
--------- End ---------

内容中包含的图片若涉及版权问题,请及时与我们联系删除

