生成式AI激起產業革新,但也引發不少實用性討論,尤其是幻覺、偏見和引用來源不明,進而催生出一系列AI治理新方法。醫藥產業的另一場轉型:運用真實世界資料(Real world data,RWD)和真實世界證據(Real world evidence,RWE)的醫藥研究,業界常簡稱為RWD研究,也面臨了類似的資料透明度不足的治理挑戰。
日本老牌製藥大廠塩野義製藥特別點出這個問題,傳統新藥開發以臨床試驗為主,流程明確、資料標準化、倫理與法規兼備。但當資料來源擴大到病歷資料、健保申報數據甚至穿戴裝置時,這類非臨床試驗的RWD研究,開始暴露出系統性的透明度問題,像是沒人知道資料如何取得、分析、是否有偏差,甚至沒人要求研究人員揭露這些細節。
對此,塩野義製藥選擇主動治理。他們從2018年自建的臨床試驗AI分析平臺出發,延伸打造一套適用於RWD研究分析流程的工具,透過標準化、半自動化與程式化治理,來提高RWE可信度和研究效率。
RWD研究興起,卻充滿問號
塩野義製藥成立於1878年,是日本最老牌的製藥公司之一,專攻藥物開發和創新工具研發,自己有一組專門的資料科學團隊。
該團隊工程師Takuji Komeda引用一份研究,指出日本產學界用RWD進行藥品或療效分析的研究數量,正在快速增加。然而,資料取得和分析缺乏制度化監管,導致外界時常對RWD研究存疑。
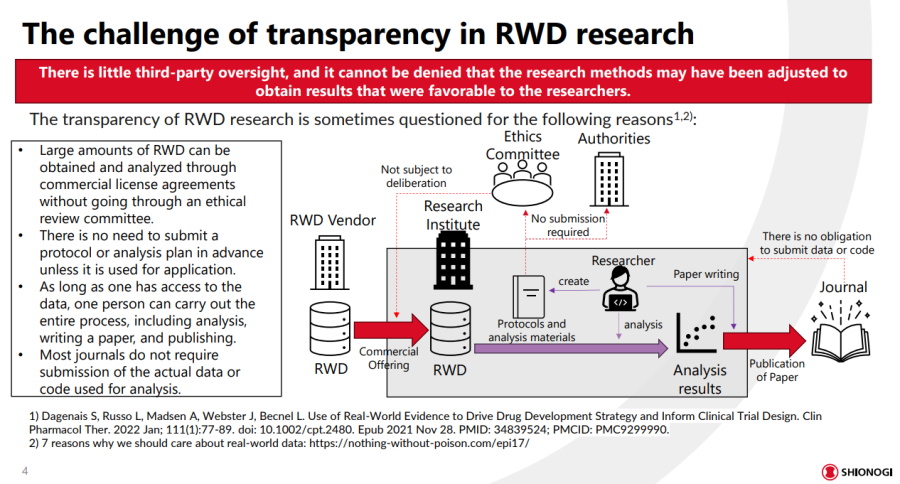
塩野義製藥指出,日本真實世界資料(RWD)研究缺乏制度化監管,比如研究員可向供應商取得大量RWD資料,不必經過倫理審查,也不必向倫理委員會提出分析計畫,多數期刊更不會要求投稿者公開原始資料。圖片來源/塩野義製藥
他舉例,研究人員可以直接透過商業授權,不必經過倫理審查,向供應商取得大量RWD資料。而且因為不是臨床試驗,研究人員也不必向倫理委員會提出分析計畫,而大部分刊登研究成果的醫藥期刊,更不會要求投稿者公開程式碼或原始資料,其中更缺乏獨立審核的第三方。換句話說,任何人都可能從商業授權取得的RWD資料中,「挑出自己想看的結果」,然後寫一篇論文就發表了。這種狀況與生成式AI幻覺、缺乏明確出處和人類審查的問題非常類似,治理缺失、過程不透明,讓RWD研究價值大打折扣。
無法直接套用臨床試驗SOP,決定另外開發
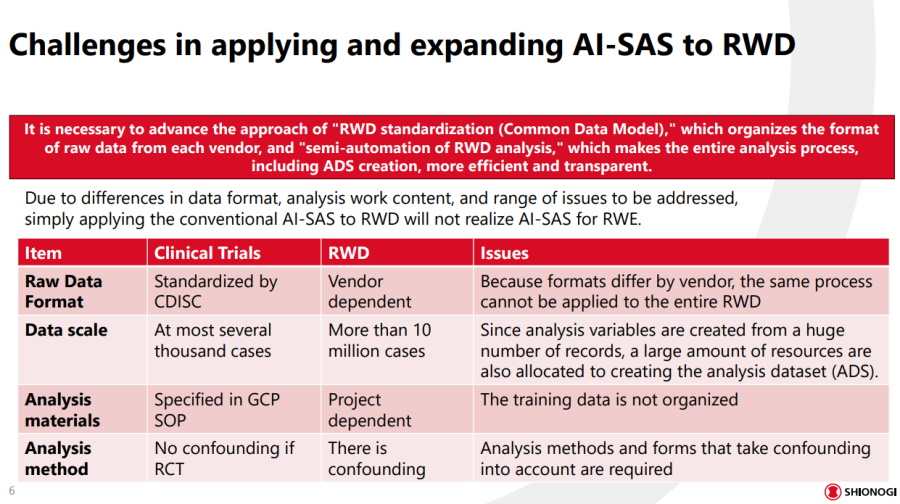
塩野義製藥本想以自建的臨床試驗AI平臺為基礎,來打造RWE半自動化和監管工具,卻面臨資料格式、資料規模、分析方法等差異的挑戰,於是決定重新開發一套專屬工具。圖片來源/塩野義製藥
塩野義製藥早在20年前就採用商用數據分析產品,來輔助藥物研發和臨床試驗,2018年時用SAS的Viya平臺為基礎,開發出臨床試驗專用的AI-SAS平臺工具。後來,他們想進一步擴大這個平臺,發展一套讓RWD研究更透明且能自動化的工具。
團隊先評估原有工具使用真實世界資料的可行性,但因原有系統設計以臨床試驗為主,能處理的資料格式、規格、分析方法和模型,都與RWD截然不同。
比如在資料格式上,臨床試驗採用CDISC國際標準,但RWD的標準沒有統一,會因資料供應商而有不同,另外在資料規模上,臨床試驗頂多幾千筆案例,但RWD動輒高達上千萬筆。不只如此,在分析方法上也有所差異,比如臨床試驗為隨機對照設計,可控制偏誤,但RWD多混雜因子,需額外建模。
因此,塩野義製藥決定重新打造一個可支援大規模資料、格式彈性、分析半自動化且記錄完整的RWD分析架構。
先將資料標準化,再半自動化分析
接著,塩野義找來原廠提供技術支援,打造可用於真實世界資料研究的新版分析工具AI-SAS for RWE。這套系統分為2大關鍵模組,包括資料標準化模組,以及半自動化的RWD分析流程,同時保有版本控管與審查記錄。
以資料標準化模組來說,為解決不同RWD來源格式不一的問題,塩野義製藥採用國際OMOP提出的CDM通用資料模型,作為資料標準,好將世界各地供應方提供的RWD,轉換為CDM,方便後續分析。
不過,Takuji Komeda坦言,日本的RWD難以完全轉換為CDM,因此,塩野義只針對欄位格式和欄位命名進行一致化,讓各種格式資料在平臺中具備一致結構。他們稱這種CDM為「實用型標準化」做法,保留原始資料語意,但透過結構統一達到跨資料比對的目的,避免因代碼轉換,丟失資訊。
接著是半自動化RWD分析,塩野義團隊規畫了3個階段來完成。第一,研究人員只要填好一份概念表(Concept Sheet),列出要研究什麼、需要哪些變數和使用哪些統計方法,系統就會根據先前資料定義,自動套用變數格式、建立分析資料集(ADS)及其規格。
建好初步分析資料集後,系統會進一步分析哪些變數需要擴充或轉換,並根據既有規則或過往範例,自動補足這些內容,同時生成統計圖表(TLF),並根據這些圖表,自動產出報告草稿,來供研究員參考。
所有分析流程都會自動記錄在Git中,包含程式版本、資料欄位定義版本、報表更新紀錄等。這種設計類似軟體工程的CI/CD流程,可讓研究人員能追蹤任何一步的修改,達到可溯源的治理效果。未來若監管機構、倫理委員會或期刊審查要求提出分析過程依據,他們就能快速匯出完整紀錄。
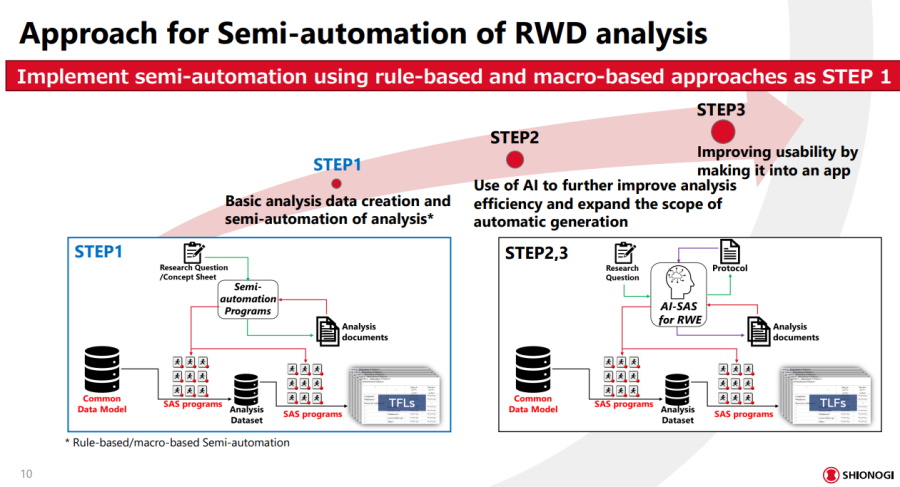
最終,塩野義製藥打造一套AI-SAS for RWE工具,透過標準化、半自動化與程式化治理,來提高RWE可信度和研究效率。他們目前已完成第一階段,包含半自動化和Git記錄,接下來要用AI改善分析效率,還要建成App來強化可用性。圖片來源/塩野義製藥
上述這些做法,只是分析流程半自動化的第一階段。Takuji Komeda指出,塩野義團隊預計,第二階段要進一步使用AI來加強分析效率,還要擴大可以自動化的規模。而在第三階段,他們要將整個分析作業包裝成App,讓非程式專業的研究人員,也能用圖形介面完成RWD分析設定,提高可用性。
塩野義製藥的RWD/RWE治理做法,成了RWE用於未來藥物研發和監管的可信依據。


