DRUGAI
今天为大家介绍的是来自北京药理毒理研究所的Feng Jiannan与北京生物技术研究所的Ren Hongguang团队发表的一篇论文。在免疫治疗领域,抗原肽(Antigenic Peptides)通过主要组织相容性复合体(Major Histocompatibility Complex, MHC)呈递并被T细胞受体(T Cell Receptor, TCR)识别这一过程扮演着关键角色。研究团队开发了一个名为UniPMT的人工智能预测系统,专门用于预测抗原肽、MHC和TCR三者之间的结合情况。实验结果表明,这一系统在预测准确度方面实现了重大突破。以肽段-MHC-TCR结合预测为例,其预测准确率比现有方法提高了15%。在实际应用中,UniPMT不仅能准确预测T细胞的增殖反应,在新抗原特异性结合预测方面的表现更是优于现有方法,准确率提升幅度高达17.62%。更重要的是,该系统能够清晰地解释预测结果,帮助研究人员理解关键结合位点,并对结合概率进行精确计算。这些特点使UniPMT在抗原肽的发现、疾病免疫治疗以及新型疫苗设计等领域展现出广阔的应用前景。

免疫治疗研究中,科学家们一直在探索抗原肽、主要组织相容性复合体(MHC)和T细胞受体(TCR)三者之间的结合机制。由于实验方法耗时费力,研究人员开始转向计算机辅助预测方法。早期的预测方法主要分为两类:一类是使用统计评分函数计算结合概率的评分法,另一类是利用深度神经网络学习序列特征的学习法。随后,针对肽段和TCR的结合预测,又相继开发出了TEIM3、TCR-AI和PanPep等专门工具。然而,这些方法往往只关注其中两种分子之间的结合,忽视了三者之间可能存在的相互影响。为解决这一问题,研究团队开发了UniPMT模型。这个创新模型采用异构图神经网络(Heterogeneous Graph Neural Networks)技术,在三个层面实现了突破:
数据层面:整合了不同类型的分子及其相互作用信息。
框架层面:通过异构图神经网络捕捉复杂的生物分子互作关系。
训练层面:结合深度矩阵分解(Deep Matrix Factorization)和对比学习(Contrastive Learning)技术,实现多任务协同训练。
实验证明,UniPMT在预测准确度上大幅领先现有方法,尤其在预测三种分子共同结合方面的准确率提升了15%。这一突破对于肿瘤免疫治疗具有重要意义,特别是在设计TCR基因工程改造的T细胞治疗方案时,可以帮助医生更准确地预测治疗效果。
模型架构
UniPMT是一个创新的人工智能预测系统,它能同时预测三种重要的生物分子(病原肽段、I类主要组织相容性复合体和T细胞受体)之间的结合关系。与之前只能预测两种分子间结合的方法相比,UniPMT实现了重大突破。如图1所示,UniPMT的工作流程可以分为三个步骤:
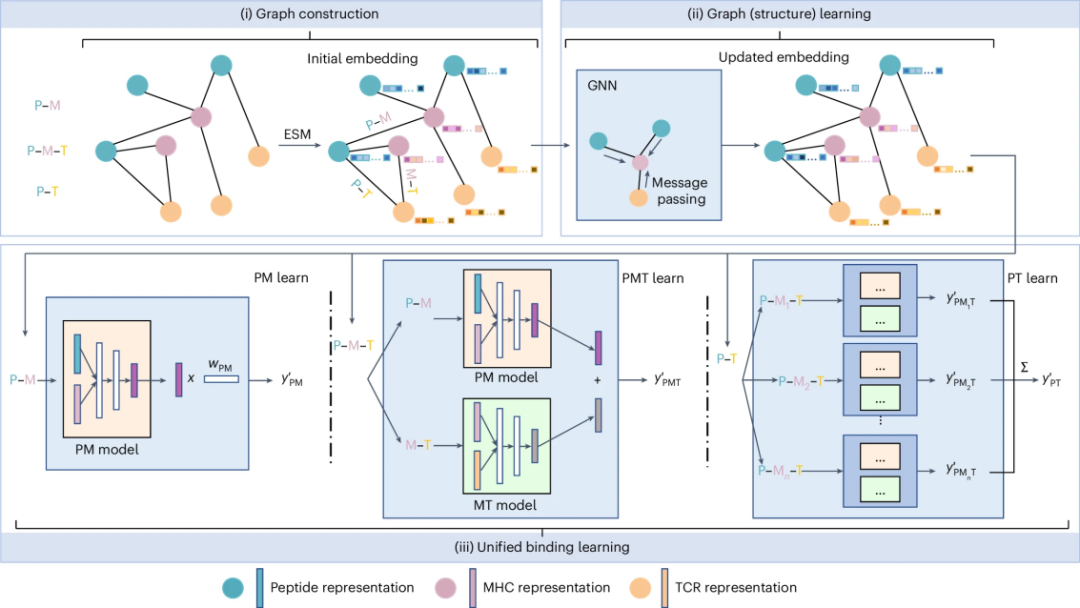
图 1
数据准备:系统首先使用进化尺度建模(Evolutionary Scale Modeling, ESM)技术分析肽段和TCR的特征,同时采用TEIM方法提取MHC的关键信息。这些生物分子被转化为计算机可以理解的数据节点,它们之间的相互作用则被表示为连接线。
特征学习:通过GraphSAGE图神经网络技术,系统能够深入理解这些分子之间错综复杂的关系网络,就像解读一张包含丰富信息的关系图谱。
结合预测:最后,系统运用深度矩阵分解(Deep Matrix Factorization)技术,将所有学到的信息整合起来,对三种分子之间可能的结合情况进行综合预测。预测结果以0到1之间的概率值表示,数值越接近1,表示结合的可能性越大。
这种创新的设计使UniPMT能够全面把握分子间的相互作用,从而在预测准确度上实现了显著提升。这对于开发新的免疫治疗方案具有重要的指导意义。
UniPMT在三种核心预测任务上的性能
如图2所示,研究团队对UniPMT系统进行了全面的性能测试,重点评估了三个核心预测任务:
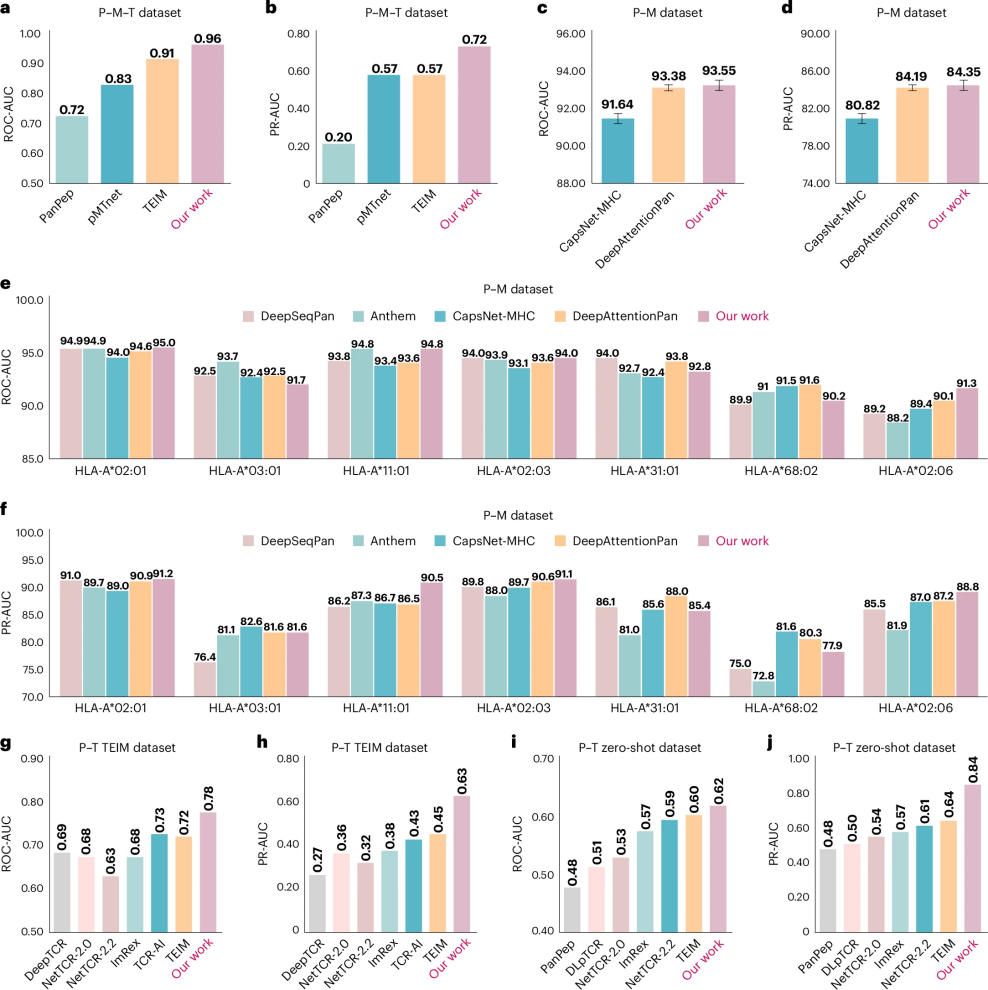
图 2
对于三分子(肽段-MHC-TCR)结合预测,在包含近3万个训练样本的标准数据集上,UniPMT的预测准确率显著超越现有方法,整体预测准确度提升15%以上。在更具挑战性的新抗原数据集上,尽管整体准确率有所下降,但仍比其他方法提高了5%以上。对于双分子(肽段-MHC)结合预测,研究团队在超过15万对样本的IEDB数据集上进行测试,虽然现有方法在这一任务上已经相当成熟,UniPMT仍实现了小幅提升。对于双分子(肽段-TCR)结合预测,在常规预测中的UniPMT准确率提升18%以上,在更具挑战性的零样本预测(预测全新的肽段-TCR配对)中准确率提升20%以上。为了深入理解系统的工作机制,研究人员还进行了详细的组件分析。结果表明,三种分子之间的相互作用信息都对提高预测准确度起到了重要作用。特别是在预测肽段和TCR的结合时,考虑MHC的信息能显著提升预测效果。这一发现验证了整合多种分子信息的科学价值,为未来的免疫治疗研究提供了新的思路。
UniPMT在P-M-T结合预测以及T细胞增殖上的表现
如图3所示,UniPMT在下述两个关键领域的临床应用中展现出了重要价值:
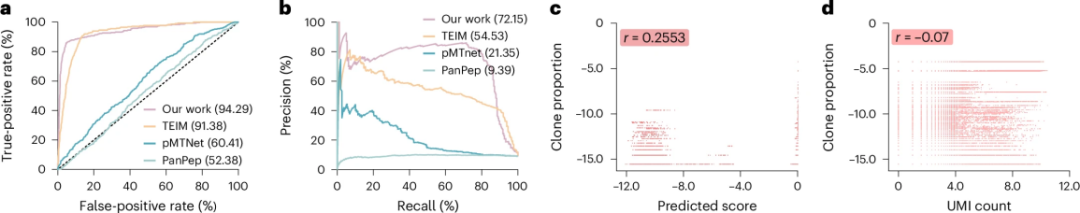
图 3
提高肿瘤免疫治疗的精准性:在细胞治疗中,找到能够精确识别肿瘤的T细胞是治疗成功的关键。研究团队收集了312组经实验证实的案例,每组包含新抗原、呈递该抗原的MHC分子,以及能够识别它们的T细胞受体。测试结果显示:
UniPMT的预测准确度达到94.29%,比现有最佳方法提高了近3%;
在识别特定抗原的T细胞方面,准确率提升超过17%这一突破意味着医生能够更准确地筛选出适合进行细胞治疗的T细胞,有望提高治疗的成功率。
预测T细胞的增殖能力:研究人员发现UniPMT不仅能预测结合情况,还能预测T细胞的增殖潜力。通过分析来自健康志愿者的单细胞数据:
UniPMT的预测结果与T细胞实际增殖情况显示出明显的正相关;
这种预测能力优于传统的分子标记方法;
这一发现对于优化细胞治疗方案具有重要指导意义,可以帮助医生选择更有潜力的T细胞进行治疗。
P-M-T结合的关键位点分析与发现
UniPMT不仅能预测分子间的结合,还能帮助研究人员理解结合过程中的关键位点,这对开发更有效的免疫治疗方案具有重要意义。如图4所示,研究发现主要包括三个方面:
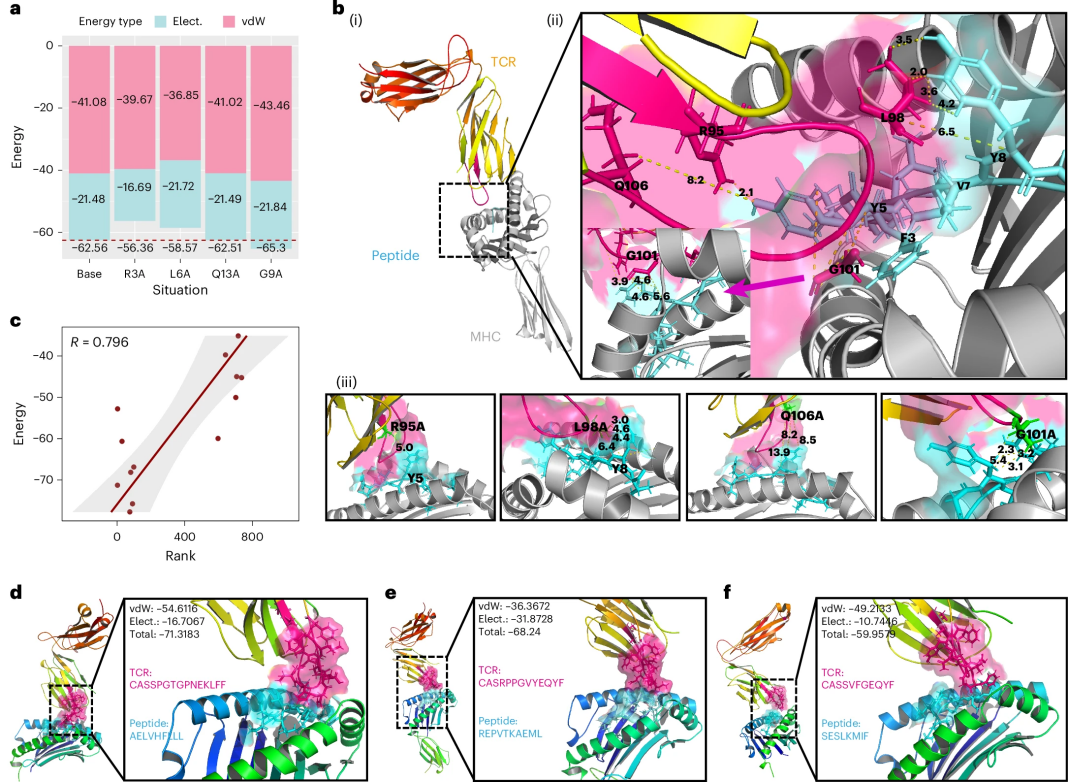
图 4
首先,对于关键结合位点的识别,研究团队采用了一种巧妙的“替换实验”方法:将蛋白质中的特定氨基酸替换成最简单的氨基酸(丙氨酸),观察这种改变对分子结合的影响。实验证实:UniPMT准确预测出的关键位点(如R3、L6、Q13)在替换后会显著影响分子间的结合,而预测的非关键位点(如G9)在替换后几乎不影响结合。其次,对于分子结构层面的验证,通过详细分析分子间的结合结构,研究人员发现关键位点的改变会显著影响分子间的结合距离。例如,R95位点的改变导致结合距离增加一倍多。这些发现与UniPMT的预测高度吻合,证实了模型的可靠性。最后,在新型治疗靶点的发现方面,研究团队进一步将UniPMT应用于新抗原的筛选。研究团队从癌症抗原数据库中筛选出43个候选抗原,并且预测出超过13万个可能的结合组合。通过结构模拟验证,发现UniPMT的预测结果与实际结合能力高度相关(相关系数0.796)。这些发现对癌症免疫治疗具有重要意义:它不仅能帮助医生选择更有效的治疗靶点,还能为开发新型免疫疗法提供理论指导。特别是在肿瘤浸润淋巴细胞难以富集的情况下,UniPMT的预测能力可以大大提高治疗方案的设计效率。
讨论
由于识别由I类MHC呈递的致病性肽段的TCR结合特异性具有广泛的临床应用,因此迫切需要有效的P–M–T(肽段-MHC-TCR)结合预测模型。研究团队提出了UniPMT——一种通用框架,可为多种场景(包括P–M–T、P–M和P–T结合预测)构建鲁棒的预测模型。UniPMT的优势在于其整体性方法,通过整合异构数据集和学习任务于单一模型中,实现了对结合现象的全面理解与预测,增强了模型在免疫治疗预测中的适用性,并揭示了深层的生物学机制。
尽管UniPMT在P–M–T、P–M和P–T结合预测中优于现有方法,但仍存在以下改进空间:(1)UniPMT基于异构图神经网络训练,当更多训练数据可用时,其性能可进一步提升;(2)与先前研究类似,UniPMT仅考虑TCR的CDR3 β链与肽段的相互作用,但新抗原的TCR预测可能还依赖其他链(如α链)的捕获键作用,整合此类信息有望提高模型性能;(3)随着三维晶体结构数据的积累,融合肽段、MHC和TCR的三维数据可能进一步优化P–M–T结合预测。
编译|于洲
审稿|王梓旭
参考资料
Zhao Y, Yu J, Su Y, et al. A unified deep framework for peptide–major histocompatibility complex–T cell receptor binding prediction[J]. Nature Machine Intelligence, 2025: 1-11.
内容中包含的图片若涉及版权问题,请及时与我们联系删除

