
点击蓝字 关注我们

微末生物
Nanomega CryoAI
肾细胞癌(RCC)是一种常见的癌症类型,约有40%的肾癌患者可能会出现转移。一旦发生转移,患者的5年生存率将大幅下降至约12%。因此,如果能够深入了解并控制肾癌转移的机制和途径,将显著提升肾癌的治疗效果。在70%的肾癌病例中,抑癌基因von Hippel-Lindau(VHL)的功能丧失较为常见。VHL蛋白(pVHL)通过泛素介导的降解过程,调节缺氧诱导因子HIF1α和HIF2α的表达。当肾癌患者缺失pVHL时,HIF1α和HIF2α将稳定表达,进而诱导缺氧反应,这促使肾癌肿瘤生长出大量血管,从而赋予肿瘤高度的转移潜力——常常导致肿瘤转移到肺部。
外泌体是细胞释放到胞外的囊泡。在像肿瘤这样的缺氧环境中,细胞产生的外泌体数量比在常氧环境中更多。由于缺氧产生的外泌体能够促进血管生成、上皮-间质转化以及与转移相关的基因表达,从而帮助细胞在不利条件下的运动、逃逸和存活,使细胞适应缺氧环境。而功能正常的pVHL可以阻止这种低氧反应的发生。因此,VHL(-)细胞释放的外泌体可能是促进肾癌肿瘤转移的驱动因素。加州大学David Geffen医学院Junhui Hu和Lily Wu及其团队通过电镜评估了来自VHL(+)和VHL(-)细胞的外泌体,以探究它们对异质性肾癌中肿瘤转移的作用。
外泌体形态和标志物表达分析
首先研究者利用lenti-CRISPR分别建立了小鼠(Renca)和人(ACHN)的VHL(+) 、 VHL(-)细胞系。透射电镜(TEM)显示,肾癌外泌体的形态与典型外泌体形态一致,中心有一个凹痕,大小在30到100 nm之间(图1A)。动态光散射(DLS)确定了外泌体的大小分布概况(图1B)。RC-VHL(+)和AC-VHL(+)外泌体最常见的大小分别为58.8 nm和68.0 nm。在VHL(-)外泌体中,RC-VHL(-)大小主要为50.7 nm,AC-VHL(-)最多的外泌体为78.8 nm和91.3 nm。
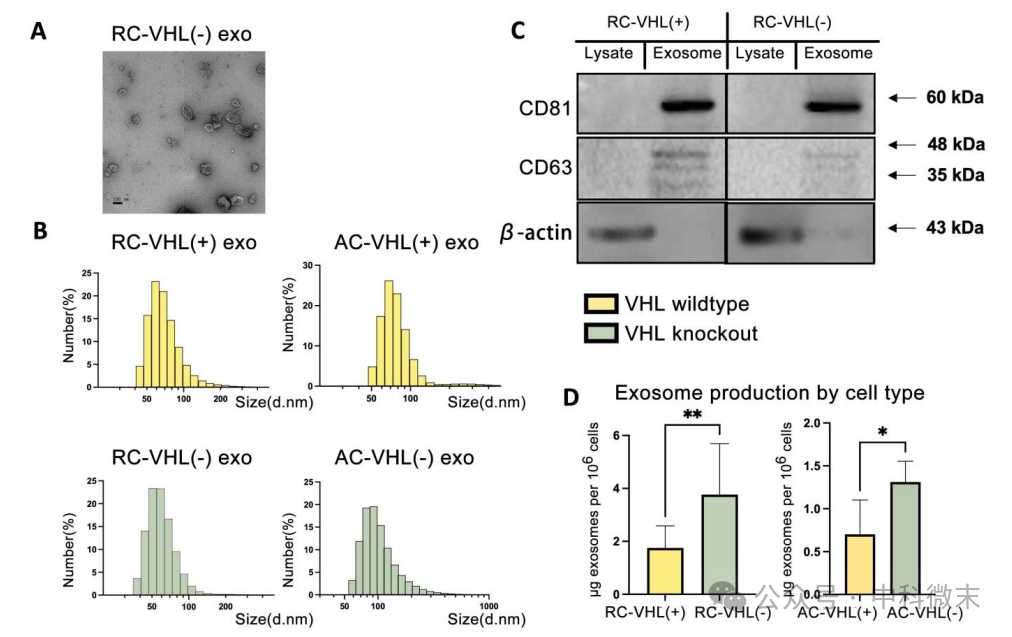
图1 :肾癌细胞外泌体的物理生化特性
通过采用经典的外泌体标志CD63和CD81进行了Western blotting,表明该研究的方案从Renca和ACHN细胞系的细胞成分中都有效分离了外泌体。外泌体浓度在VHL敲除细胞和野生型pVHL细胞之间存在显著差异(图1D),证明了研究者的猜想:即在更缺氧的环境中肾癌细胞会产生更多的细胞外囊泡。在上皮向间质转化(EMT)过程中,细胞通常会失去上皮标志转为表达间质标志,并表现出更多的迁移和侵袭行为。研究者通过将RC-VHL(+)细胞与从RC-VHL(+)或RC-VHL(-)细胞中收获的外泌体孵育后发现,与RC-VHL(-)外泌体孵育可显著增加间充质标志蛋白的表达,且这种变化不是EMT转录水平改变导致的。
VHL(-)外泌体
促进VHL(+)细胞的迁移和侵袭
接下来该研究通过二维和三维实验中探究了外泌体是否可以增加VHL(+)细胞的迁移。在42小时的过程中,RC-VHL(-)外泌体处理的RC-VHL(+)细胞二维迁移增加(图2B)。在24 h时,对照组和实验组之间没有显著差异,这可能是由于外泌体内化和起作用所需的初始时间,估计约为24 h。同时实验结果表明在Renca细胞和ACHN细胞中,VHL(+)外泌体对细胞侵袭能力没有显著影响,而VHL(-)外泌体使细胞侵袭的数量增加了约1.5 - 2.0倍(图2E, F)。接下来,研究者通过MTS四氮唑法检测发现肾癌细胞外泌体不会增加细胞增殖,但来自VHL(-)的外泌体在VHL(+)细胞中诱导EMT样表型,一些EMT标志上调,迁移和侵袭能力增强。这与研究者的预期一致,即VHL(-)细胞是转移驱动因子,将VHL(+)细胞转化为更具侵袭性的状态,并有助于远处转移。
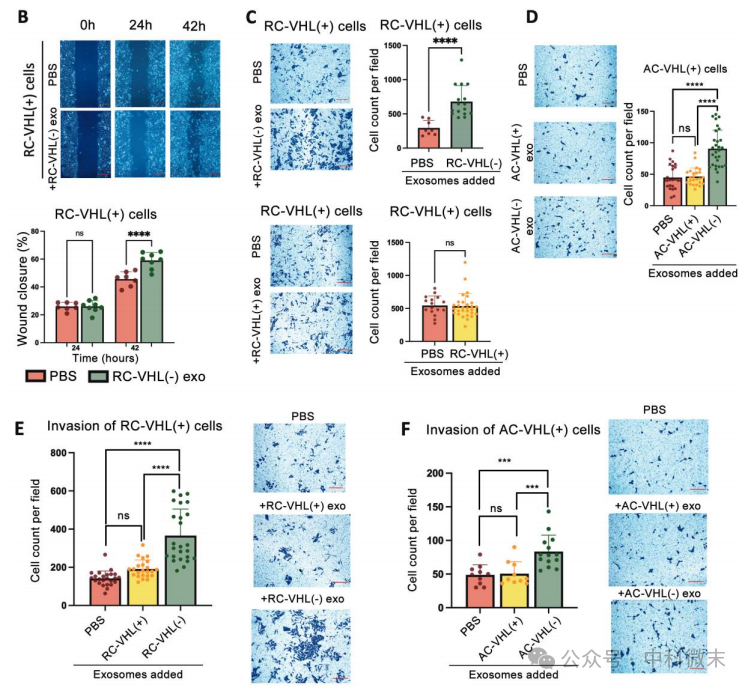
图2 :VHL(−)外泌体促进VHL(+)上皮-间质转化、迁移和侵袭
外泌体摄取和Cre-loxP系统验证
接下来,该研究用PKH67染色VHL(-)外泌体确定摄取过程。与外泌体孵育24小时后,二维图像显示外泌体在细胞边界内,三维成像(图3)确认外泌体内化并定位于细胞核附近(DAPI,蓝色)。图像表明,对于Renca和ACHN细胞系来说,24小时足以使外泌体内化到细胞中。
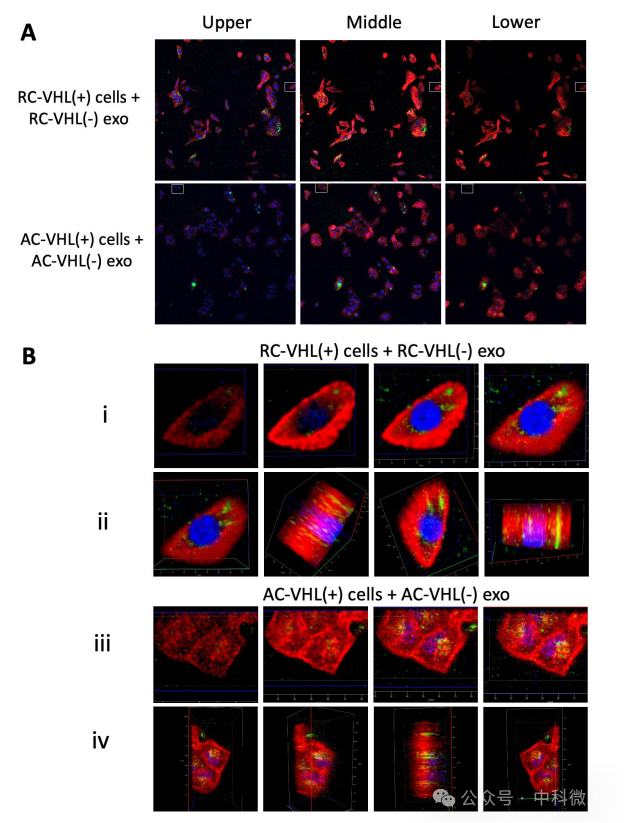
图3 :VHL(−)外泌体内化到VHL(+)细胞中
为了评估内化外泌体是否影响细胞迁移,研究者设计了Cre-loxP系统(图4A)。在时间0h时,将RC-VHL(-)-Cre细胞的外泌体加入到RC-VHL(+)-loxP细胞中,此时,受体细胞保持RFP的表达(图4C);24 h后,部分受体细胞完成颜色变化,表达GFP,而其他细胞可能仍同时表达RFP和GFP,呈现黄橙色。这一结果表明,外泌体在受体细胞中内化并发挥功能需要24小时的窗口期。第28小时,表达GFP的细胞数量增加,因为更多的RC-VHL(+)-loxP细胞完成了cre诱导的颜色转换。流式细胞术证实了这些发现,显示在不添加RC-VHL(-)-Cre外泌体的情况下,几乎没有GFP转化,然后在添加外泌体后,GFP的增加与RFP的减少以剂量依赖的方式同时发生(图4D)。因此,Cre-loxP外泌体摄取系统的结果证明了肾癌细胞摄取了外泌体后迁移功能上调。
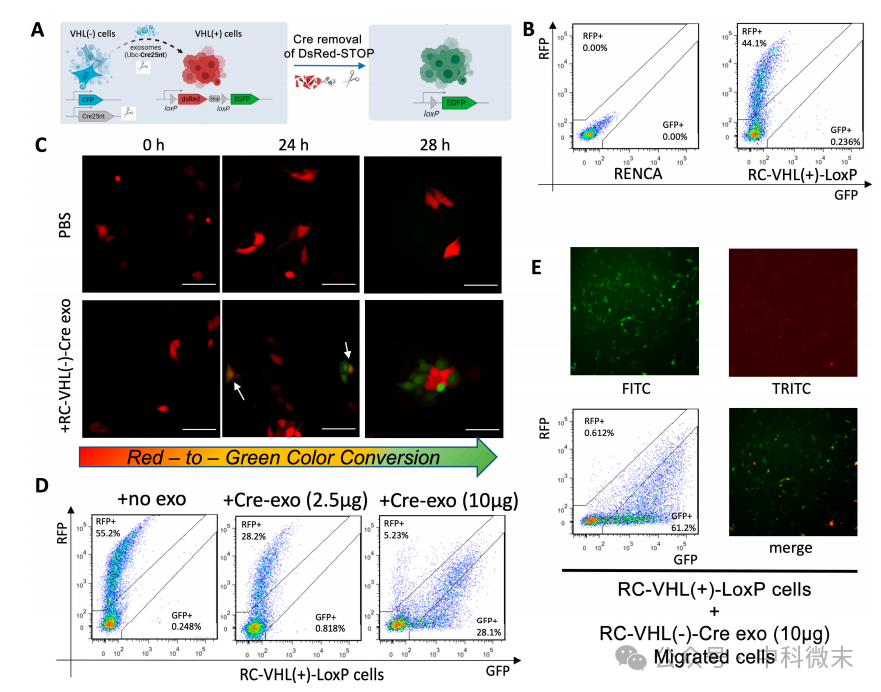
图4 :Cre-loxP系统显示颜色的转化
VHL(-)外泌体
促进RCC在卵黄囊模型中的迁移
为了探究外泌体治疗对鸭绒毛膜尿囊膜模型(dCAM)中卵内肿瘤生长和转移的影响,该研究在胚胎中建立了微转移(图5A)。RC-VHL(+)细胞用RC-VHL(+)外泌体/RC-VHL(-)外泌体处理,以及不用外泌体处理,发现肿瘤生长14天后发现肝脏是胚胎中血管化程度最高的器官,具有很高的潜力转移部位。这与人类临床上常见的肾癌向肺转移不同。PBS、RC-VHL(+)-exo和RC-VHL(-)-exo治疗培养14天后,RC-VHL(+) CAM肿瘤的平均重量分别为0.6 g、0.5 g和0.75 g,无统计学意义。通过小鼠与禽类DNA的定量PCR比例来评估了小鼠RC细胞转移到肝脏的程度(图5C)。对照RC-VHL(+)细胞组和RC-VHL(+)-exo处理组均未检测到小鼠β-肌动蛋白DNA。只有RC-VHL(-)-exo处理组在鸭胚肝脏中检测出小鼠DNA且显著高于其他两个处理组。这些结果证实了VHL(-)而非VHL(+)细胞的外泌体能够诱导VHL(+)细胞进行迁移和侵袭行为。
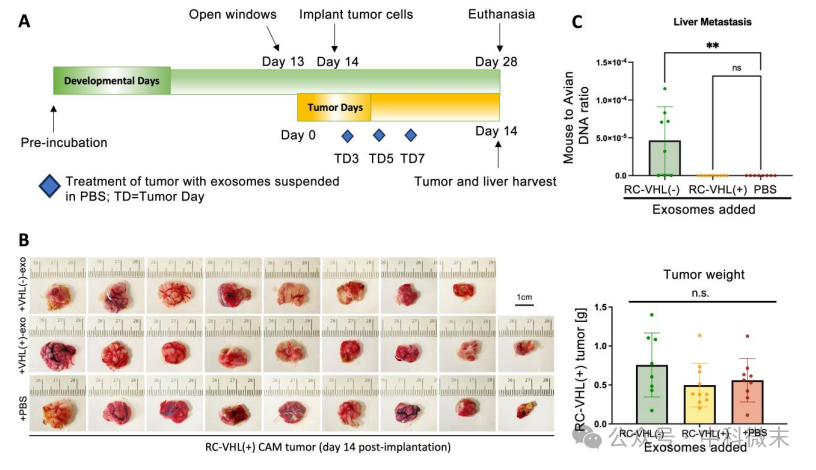
图5:动物模型中VHL(+)-exo诱导VHL(+)肿瘤远处转移
总结
该研究通过构建VHL缺失和非缺失的肾癌细胞系,分离了这些细胞系分泌的外泌体并通过透射电镜观察到了其关键的的生物学特性。研究发现,与VHL非缺失细胞相比,VHL缺失细胞分泌的外泌体显著增加了VHL非缺失细胞的上皮间质转化(EMT)和迁移能力。通过Cre-loxP外泌体报告系统,研究者观察到VHL缺失外泌体的剂量依赖性递送与荧光颜色转换和细胞迁移之间的相关性。在鸭胚绒毛尿囊膜(dCAM)模型中,VHL缺失外泌体甚至能够诱导完整的远端转移链,而VHL非缺失外泌体则不能,最终证明VHL缺失细胞来源的外泌体能够促进肾癌肿瘤的转移。
正是通过透射电镜的高分辨率观察,我们得以直观地看到外泌体的形态和结构、分布和定位,为揭示其生物学特性提供了有力证据。此技术在本研究的应用,不仅加深了我们对肾癌转移机制的理解,也为后续研究提供了可靠的技术支持,为肾癌的防治策略研究奠定了基础。
微末生物
Nanomega CyroAI
欢迎加入公司冷冻电镜技术讨论群 一起讨论
添加公司客服马老师微信,备注“加群”
期待与您交流!

加州大学David Geffen医学院Junhui Hu和Lily Wu为本文通讯作者,Kailey Flora和Moe Ishihara为共同第一作者。
原文链接:
https://www.mdpi.com/1422-0067/24/24/17307
点击“阅读原文”,查看文章↓
内容中包含的图片若涉及版权问题,请及时与我们联系删除

