
点击蓝字 关注我们

微末生物
Nanomega CryoAI
肌营养不良症是一类严重影响人类健康的遗传病,其中最常见的是杜氏肌营养不良症 (Duchenne muscular dystrophy,DMD),平均每3,500-5,000名男性新生儿中就有1例。该疾病以肌肉进行性萎缩(逐渐演变加重的肌肉组织萎缩)和肌无力为特征,最终由肌肉萎缩导致心肺功能衰竭而死亡。
DMD的发病机制与肌营养不良蛋白糖蛋白复合体(DGC)的功能障碍密切相关。DGC是一个由10种核心蛋白组成的结构复杂的蛋白复合体,它将肌肉细胞的细胞外基质与细胞骨架连接起来,起到“分子减震器”的作用,保护肌细胞膜以免其在收缩过程中受到损伤。
尽管人们早已知道DGC在肌肉健康中起着至关重要的作用,但其分子结构一直未被解析,而这相当程度上阻碍了对此类遗传病在分子亚分子层面的了解。为解决这个难题,来自加州大学洛杉矶分校(UCLA)的周正洪教授团队利用冷冻电镜技术解析了兔骨骼肌DGC复合体的三维结构,并对其进行了深入的分析,揭示了其复杂的分子构象和功能机制。文章于2024年12月11日发表在Nature上。
DGC实验材料和整体结构
为了获得完整的肌营养不良蛋白糖蛋白复合体(DGC)复合物进行结构研究,研究人员首先使用麦芽凝集素 (WGA) 从兔骨骼肌膜中纯化DGC(这是因为,DGC之前没有建立完整的重组表达系统;且已知WGA对 N-乙酰葡萄糖胺具有强烈的亲和力,之前也被用于DGC富集)。
研究人员首先经过尺寸排阻色谱(SEC)纯化得到了DGC蛋白复合体的实验样本,随后使用Cryo-EM冷冻电镜技术,对分离的 DGC 进行了冷冻电镜单颗粒分析,揭示了DGC的跨膜结构,其特征是“钥匙状”,整体分辨率高达4.3 Å。对其从头开始的de novo原子模型构建融合了AlphaFold预测、蛋白复合体本身的结构解析、以及针对蛋白质相互作用进行的广泛的生化实验。
进一步的模型验证通过已知的N-糖基化位点来实现,这些位点与所有SG蛋白和DG蛋白(复合体中的重要成员)的细胞外结构域中的指定天冬酰胺残基相关 (图1e)。研究人员解析的天然结构具有细胞外 N-糖基化,揭示了 DGC 的九个组成成分:SG复合物,由α-、β-、γ-和δ-SG组成;SGs的紧密相关伴侣蛋白sarcospan;DG复合物,由α-和β-DG组成;以及肌营养不良蛋白-肌营养不良蛋白异源二聚体。
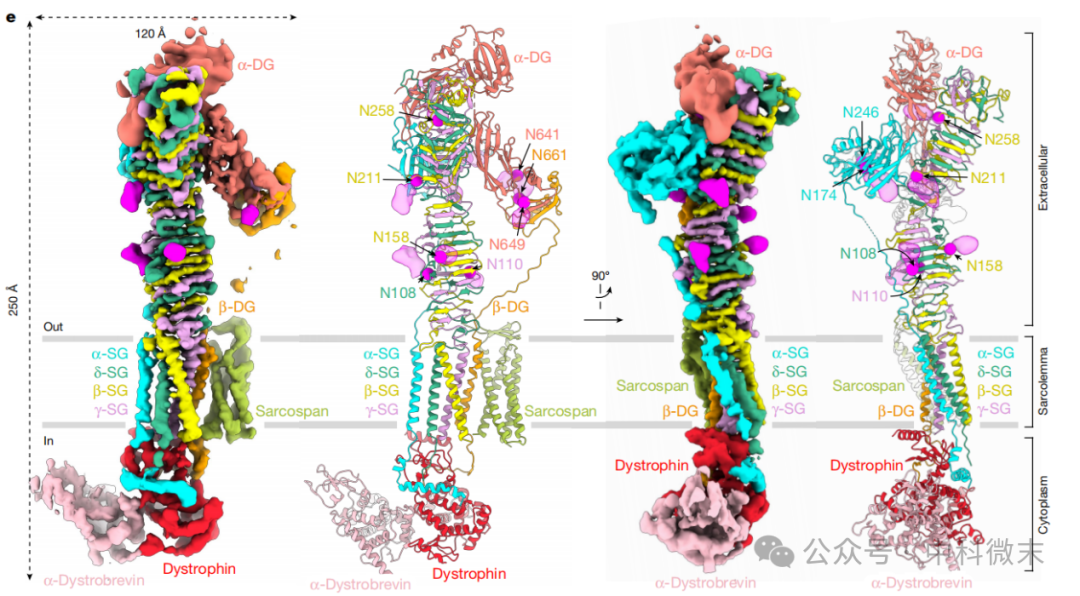
图1: DGC跨膜蛋白复合体的三维结构。
洋红色的部分即为冷冻电镜Cryo-EM三维重构所得模型中的N连接的糖基化位点,可以看到其与结构模型中天冬酰胺(N)的位置吻合,验证了模型构建的正确性
SG复合物的结构
在 β-SG-γ-SG-δ-SG 三聚体(即SG 复合物)中,II型跨膜蛋白β-、γ-和δ-SG 都类似于一种boomerang(飞去来器,即回旋镖,图2)形状,可以划分为一个“握把”、一个“臂”和一个“头部”,以反映 boomerang 的各个部分 (图 2a, 左侧)。整个复合物具有独特的结构域,其结构元素与噬菌体尾丝和溶血素中的多种常见蛋白相类似。
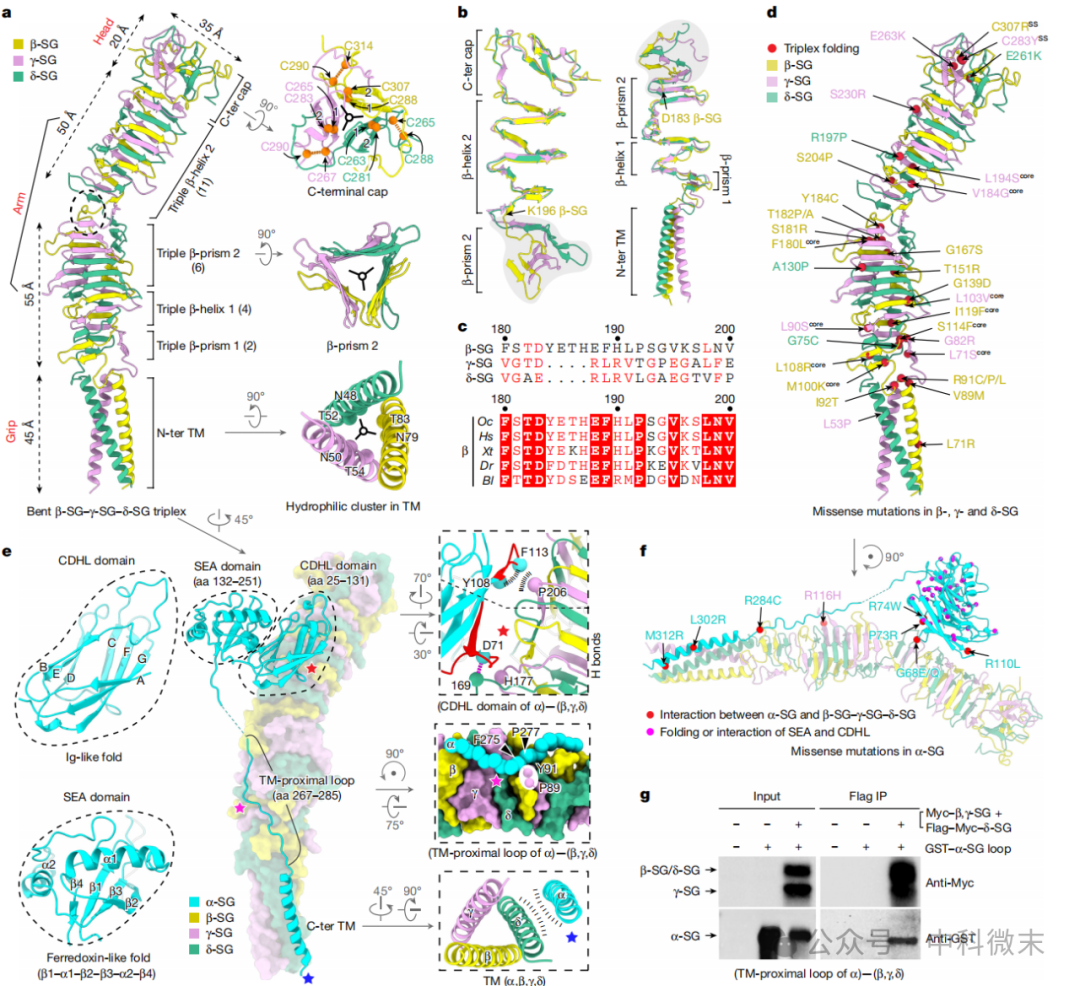
图2: SG复合物三聚体的原子结构模型,及其与α-SG蛋白的结合
三聚体的 N 端跨膜结构域,称为“握把”,形成一个扭曲的三螺旋束。该结构包含一个富含亲水基团的区域,其特征是三对中性天冬酰胺和苏氨酸残基,这很可能有助于 β-、γ-和 δ-SG 蛋白之间的对齐和相互作用 (图 2a, 右下图)。三聚体的中心“臂”跨越105 Å的距离,由相互缠绕的三重β-螺旋组成,其中有两个小的三重β-折叠结构域 (图 2a, 左侧和中间右侧)。而三聚体的C端“头部”则形成一个核心,其中每个单体都有两个β-链 (Cβ1和Cβ2)(图 2a, 右上图)。每个Cβ1链与来自其他两个单体的 Cβ1链形成主链相互作用,从而形成一个锁定的三角形连接。而每个单体的C端有着扩展的环结构,其特征是两个分子内半胱氨酸对,它们一方面确保了单体的稳定性,另一方面通过主链与相邻 C 端环的相互作用促进了三角形连接的形成 (图 2a, 右上图)。实践证明,这些半胱氨酸对于结构的维持非常重要,γ-SG中的C283Y或β-SG中的C307R的单氨基酸突变就足以导致LGMD (limb-girdle muscular dystrophy,肢带型营养不良,图2d)。这种锁定的C端头部与大多数一般三重β-螺旋的情况一致,即其正确组装取决于C端延伸部的起始折叠,该折叠的进行应在时空上先于相应茎结构域“拉起拉链”(zipping up)的过程 。
在整个SG 三聚体中,三种蛋白通过延伸的β-螺旋形成一个紧密的结构。β-螺旋在臂的中点附近有一个显著的弯曲,这与它们在183到196号氨基酸之间的差异有关。这个弯曲对于维持β-螺旋的曲度至关重要,并可能参与了DGC与细胞外基质的相互作用。
与三聚体结合的α-SG 是一种 I 型跨膜蛋白,它由 CDHL 结构域、SEA 结构域、一个环和一个 C 端跨膜螺旋组成。α-SG 与 β-SG 三聚体通过疏水和亲水相互作用而相互作用,并参与 DGC 的整体结构稳定。
总的来说,β-SG-γ-SG-δ-SG 三聚体的结构完整性由其握把-臂-头部部分的相互作用维持,这与之前表征的致病性单氨基酸突变拓扑结构一致,现在研究得到的结构表明,这些突变表明致病机制是通过触发三螺旋展开。
DG复合物的结构
在 DGC 结构中,DG复合物由两个CDHL-SEA模块组成,并由一个相邻的37个残基的环连接到一个跨膜螺旋和一个 C 端细胞质片段(图 3a)。这种组织方式与α-SG蛋白非常相似,因为它们都是 I 型跨膜蛋白。值得注意的是,DG的第二个SEA结构域 (SEA2) 发生翻译后自裂解,导致DG蛋白裂解成两个亚基,α-DG和β-DG(图 3a)。
尽管 DGC 的三个 SEA 结构域在整体结构上相似(Cαroot-mean-square deviation即r.m.s.d. 值为2.1到3.2),但它们的序列同源性很低,范围为8%到13%。
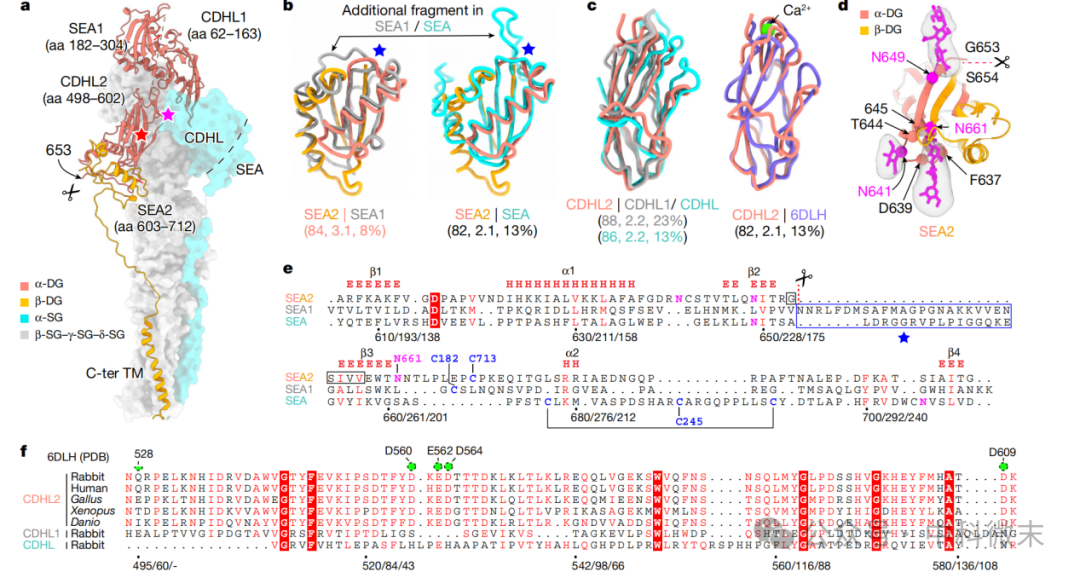
图3: DG复合物的结构(彩色部分)
值得注意的是,DG 的 SEA2 结构域与 SEA 的其他结构域相比缺少一个间隔环(图 3b,e)。这与SEA中只有SEA2在DG中具有典型的裂解位点 G|SΦΦΦ (其中 Φ 是疏水性残基,| 表示裂解位点)的观察结果一致 (图 3d,e),这表明自裂解的机制是在SEA结构域中施加构象压力,而一个较长的间隔环有利于释放机械压力,从而避免在其他的SEA结构域中 不必要的自裂解(图 3e)。
sarcospan蛋白在DGC中的作用
与 SGs 和β-DG 不同,sarcospan 具有四个跨膜螺旋,并且在 TM3 和 TM4 之间有一个长的肽插入物,称为大型细胞外环(LEL,图4)。sarcospan 的拓扑结构与四跨膜蛋白相似,被认为是一种“分子促进剂”,能够聚集和组织跨膜蛋白复合物。LEL 主要通过与 β-SG 和 γ-SG 的β-螺旋1肽残基之间的疏水相互作用与β-SG-γ-SG-δ-SG三聚体直接相互作用。此外,sarcospan的TM3和TM4结构域通过β-DG的TM结构域连接到γ-SG的TM结构域。
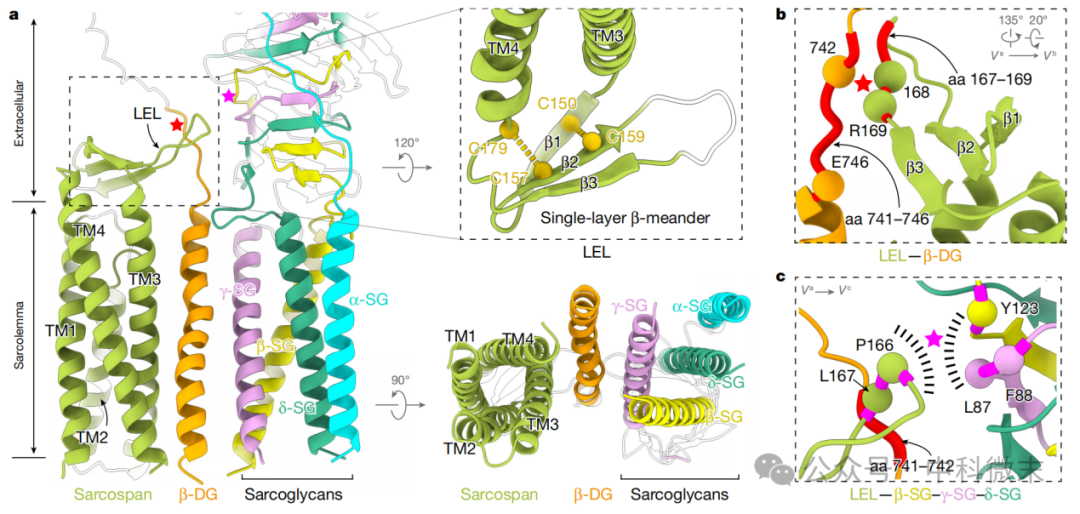 图4: Sarcospan蛋白(绿色)起到把 SGs(粉色等)和 β-DG(橙色)连结起来的作用
图4: Sarcospan蛋白(绿色)起到把 SGs(粉色等)和 β-DG(橙色)连结起来的作用
sarcospan 在维持 DG 复合物完整性方面起着重要作用。sarcospan 缺乏会导致 DG 水平显著降低,而 sarcospan 过表达会提高 DG 水平。此外,缺乏 TM3、TM4 和 LEL 的 sarcospan 副产物无法组装到 DGC 中。
肌营养不良蛋白和α-肌营养不良蛋白异源二聚体
肌营养不良蛋白(Dystrophin)结构包含一个 WW 结构域、两个 EF-hand 结构域和一个 ZZ 结构域(图5),它们共同覆盖了肌营养不良蛋白全长 C 端富含半胱氨酸区域的全部。WW 结构域具有一个由三个 β-链形成的 β-meander 模式,而两个 EF-hand 结构域,EF1 和 EF2,都是螺旋-环-螺旋结构域,折叠成 11 个 α-螺旋 (α1-α11);每个 EF-hand 结构域包含两个配对的 EF-hand 模式 (EF1为α3E–α4F 和 α5E–α6F; EF2为α7E–α8F 和 α9E–α10F)(图 5b,顶部)。肌营养不良蛋白的ZZ结构域包含β-折叠和α-螺旋元件 (β4–β5–β6–β7–α12–β8)。ZZ 结构域和EF1通过氢键直接接触,涉及ZZ结构域α12之后的环和EF1结构域 α1和α2之间的环 (图 5b,底部)。
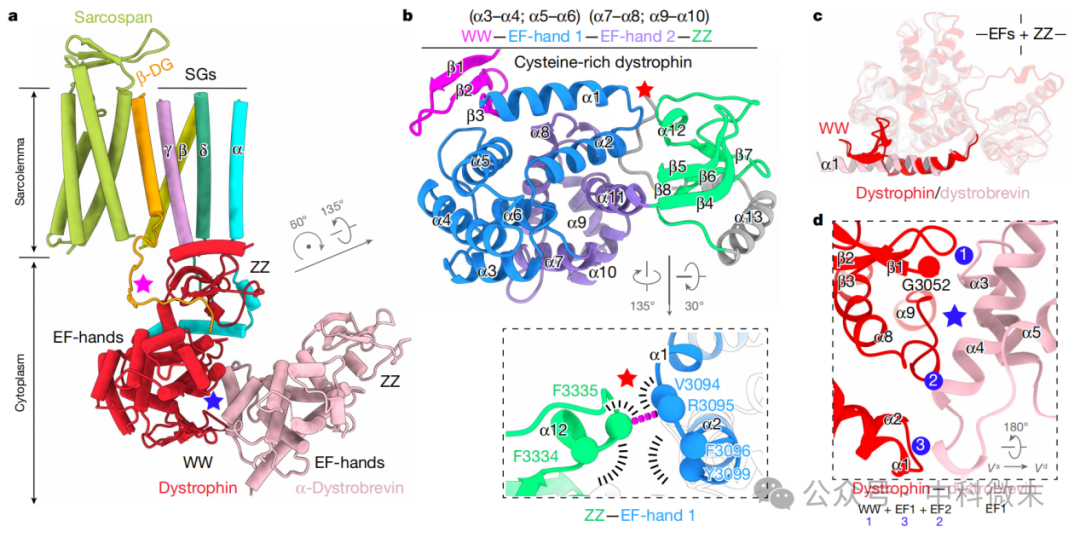 图5: DGC复合体的细胞内结构域,
图5: DGC复合体的细胞内结构域,
即肌营养不良蛋白(Dystrophin)和α-肌营养不良蛋白组成的异源二聚体
α-肌营养不良蛋白,尽管在结构上与肌营养不良蛋白的富含半胱氨酸区域相似,但缺乏 WW 结构域,而具有一个延伸的螺旋α1(图 5c)。
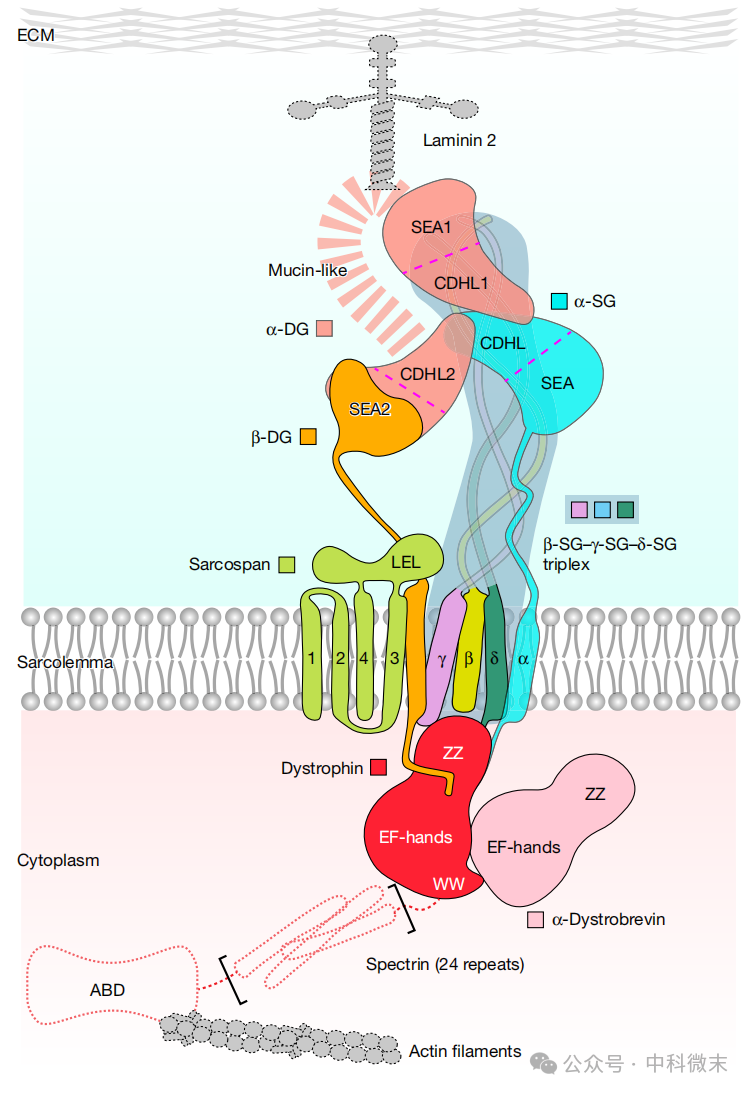 图6: 冷冻电镜揭示了肌肉细胞膜上的DGC复合物三维结构,为我们展示了不同蛋白分子实际相互作用的方式
图6: 冷冻电镜揭示了肌肉细胞膜上的DGC复合物三维结构,为我们展示了不同蛋白分子实际相互作用的方式
关于我们
这项研究不仅揭示了 DGC 的分子结构,还为肌营养不良症的治疗提供了新的思路。它为理解肌营养不良症的发病机制提供了新的视角,并为开发新的治疗方法奠定了基础。它向我们展示了结构生物学在研究复杂生物系统中的重要性,以及冷冻电子显微镜单颗粒重构技术(Cryo-EM)的强大作用,并为未来研究其他疾病提供了新的方向。
鑫研微末团队在生物大分子及其复合体的三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
微末生物
Nanomega BioAI

欢迎加入公司冷冻电镜技术讨论群 一起讨论
添加公司客服马老师微信,备注“加群”
期待与您交流!

内容中包含的图片若涉及版权问题,请及时与我们联系删除

