DRUGAI
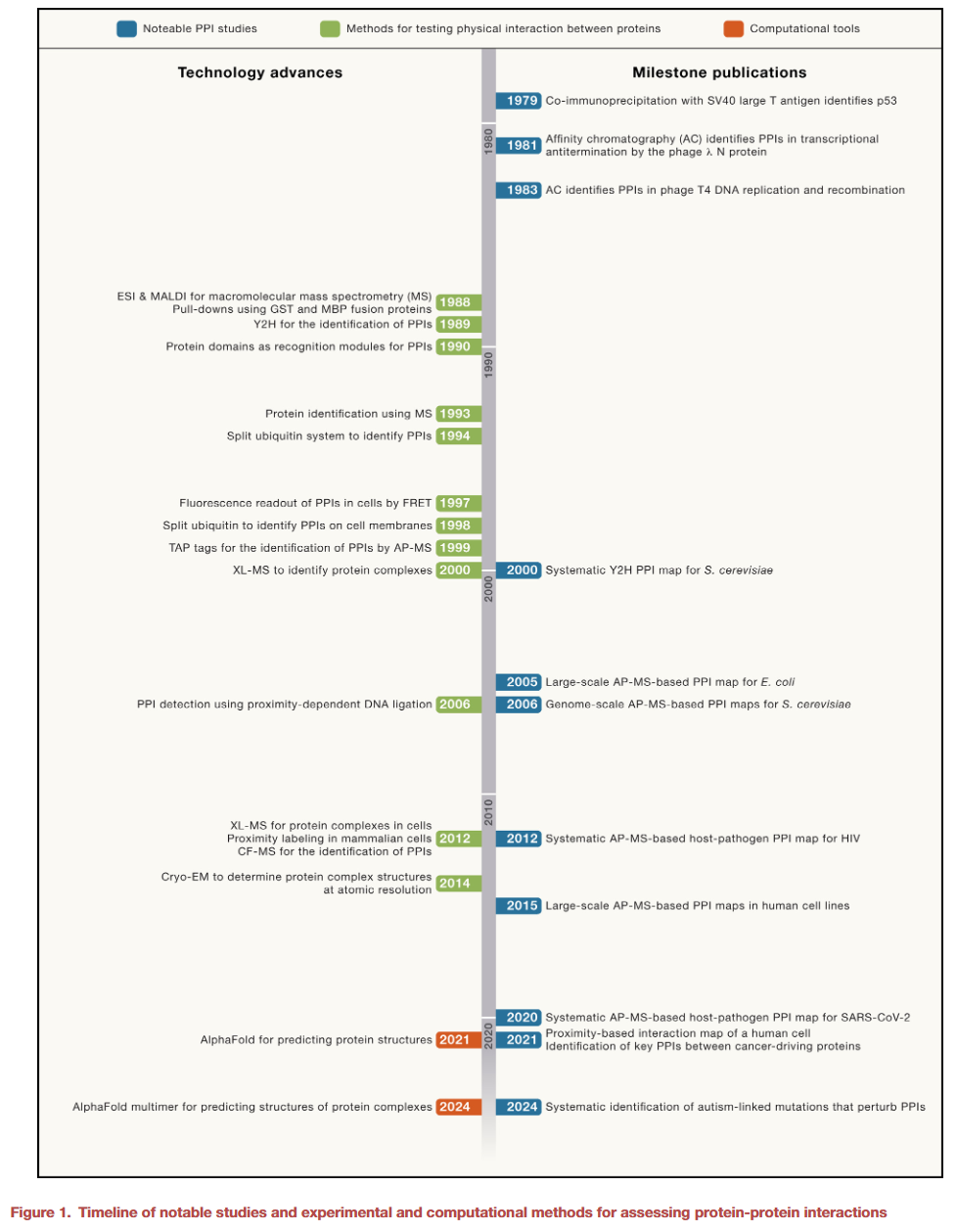
蛋白质-蛋白质相互作用(PPIs)的研究始于40多年前,通过蛋白质亲和层析和抗体共免疫沉淀等方法逐步展开。随着技术的进步,PPIs的分析从单个相互作用扩展到基因组范围,得益于细胞内标记技术、亲和纯化-质谱(AP-MS)以及共分级质谱(CF-MS)的应用。目前,结合交联质谱(XL-MS)和冷冻电子显微镜(cryo-EM)等方法,可以更精确地区分直接和间接的蛋白质相互作用。这些先进技术,加上人工智能工具(如AlphaFold)的应用,预示着未来对PPIs及蛋白质复合物的深入理解将为基础生物学和疾病研究带来全新洞见。

引言
生命所需的复杂化学反应由构成细胞约90%干质量的生物大分子决定。其中,蛋白质作为极具多功能性的聚合物,不仅催化了细胞中大部分必要的化学反应,还发挥着重要的结构性作用。上述功能通常需要蛋白质相互组装形成蛋白质复合物。许多复合物作为“蛋白质机器”发挥作用,通过有序的变构形态变化,为细胞提供有用的构象转变。部分蛋白质机器已被深入研究,其组成成分可通过纯化后在体外重新组装,并进行高分辨率结构表征。DNA转录和复制的多蛋白复合物便是两个经典例子。在这些研究中,发现和解析蛋白质机器需要针对特定生化过程建立灵敏且高特异性的检测方法,结合遗传学解析,从而识别出细胞中催化该过程的所有组分,并进行纯化与功能表征。这种方法还促使科学家深入理解了包括蛋白酶体、染色质重塑复合物、剪接体和核糖体在内的众多蛋白质机器的分子机制和结构特征(其中剪接体和核糖体的研究还强调了RNA的核心作用)。
值得注意的是,即便是最简单的已知活细胞——一种经工程设计的支原体,拥有仅473个对其繁殖至关重要的基因,其中近三分之一的功能仍不明。而对于人类基因组,即使忽略一个基因可能具有多种功能的问题,约20,000个蛋白编码基因中仍有数千个基因的功能未知。那么,要维持生命可能需要多少尚未被认知的活性?目前,在我们的细胞中可能存在数百种未被表征的蛋白质机器,而传统的生化检测方法尚无法发现它们。理解这些未知的蛋白质机器对揭示基本生物学过程和疾病状态背后的生物学机制至关重要,而这些知识对于开发急需的治疗手段具有重要意义。蛋白质-蛋白质相互作用(PPI)图谱为解决这些问题提供了一个有前景的途径。
利用蛋白质亲和层析识别PPIs对生物功能的洞察
随着技术的不断创新,细胞蛋白质-蛋白质相互作用(PPIs)的研究也取得了同步发展。由于蛋白质与其他分子之间的相互作用往往具有极高的特异性,早期识别PPIs的一些尝试利用了蛋白质亲和层析。这一技术自20世纪初起便被用作纯化特定分子结合的蛋白质,或表征酶及其他蛋白质与其底物、辅因子和其他相互作用分子的关系。随后,亲和层析方法在支撑材料的使用和配体偶联技术上得到了许多改进,尤其是将不溶性抗原用于从血清中纯化特异性抗体。一系列技术进步如琼脂糖珠的引入以及氰基溴(CNBr)活化琼脂糖的方法,使得蛋白质及其他分子能够通过一级胺基便捷地偶联到琼脂糖上,这极大地提高了实验的效率和灵活性。
尽管原则上可以通过固定化的纯化蛋白在细胞提取物中以无偏的方式寻找未知的相互作用伙伴,但这种方法直到20世纪80年代才首次用于寻找与噬菌体λ和T4蛋白相互作用的蛋白质。例如,通过λ N蛋白(一种转录抗终止因子)作为配体的亲和层析,仅保留了与琼脂糖珠支持物无非特异性结合的一个大肠杆菌蛋白。这一蛋白被识别为NusA,因为NusA的温度敏感突变会改变其特性。进一步研究表明,NusA是λ N蛋白与RNA聚合酶相互作用的适配因子,而其他宿主辅助因子如NusB、核糖体蛋白S10和NusG,也通过亲和层析显示出与转录抗终止调控系统的其他组分的相互作用。这些研究揭示了蛋白质亲和层析的强大能力,能够检测亲和力低于10⁵ M⁻¹的弱PPIs。此外,其他方法如融合蛋白的高浓度拉下实验、在细胞中过表达带标签的蛋白、或交联蛋白后进行亲和纯化等,也能够检测弱相互作用。
蛋白质亲和层析的局限性
在早期,蛋白质亲和层析需克服两个主要技术障碍。第一是需要高纯度蛋白作为配体。然而,20世纪80年代通过传统柱层析纯化蛋白的方案通常耗时且复杂,开发特定蛋白的纯化方案可能需要数年。此外,尽管20世纪70年代中期引入了重组DNA技术,但当时克隆基因的数量仍有限,蛋白质过表达载体尚未普及,且尚未引入用于简化蛋白质纯化的亲和纯化标签。
第二个障碍是如何识别相互作用蛋白。如果研究的生物系统中蛋白组分已被纯化且其在SDS-聚丙烯酰胺凝胶上的迁移率已知,识别相对容易。然而,对于那些未通过遗传学方法鉴定的相互作用蛋白,研究者需要通过推测其功能并进行适当的生化实验来确定其功能。这种直觉性的方法尽管耗时耗力,但在20世纪80年代却促成了TFIIF亚基及大量果蝇肌动蛋白丝和微管结合蛋白的纯化与鉴定。
通过抗体和融合蛋白识别PPIs的生物学新见解
蛋白质亲和层析的一个替代方法是使用针对纯化蛋白的抗体,通过免疫沉淀从细胞提取物中捕获目标蛋白及其相互作用伙伴。在这一领域的早期重要实验中,一个在SDS-聚丙烯酰胺凝胶上分子量约为53 kDa、功能未知的宿主蛋白(即如今被称为p53的肿瘤抑制因子)通过免疫共沉淀与SV40大T抗原结合,类似地,肿瘤抑制蛋白RB与其他病毒致癌蛋白相互作用。随后,在癌症生物学中,研究发现针对病毒致癌蛋白pp60v-src及其活化的细胞同源物pp60c-src的单克隆抗体,可以共免疫沉淀出含有磷酸酪氨酸的蛋白,这种相互作用依赖于src蛋白的SH2结构域。这一发现揭示了SH2结构域与含磷酸酪氨酸肽段之间直接相互作用在细胞信号网络中的关键作用。
另一个重要的成功是利用针对果蝇TATA盒结合蛋白(TBP)的单克隆抗体,共免疫沉淀了RNA聚合酶II通用起始因子TFIID的其他亚基(即TBP相关因子,TAFs),从而鉴定了这些亚基、完成其分子克隆,并在不同物种中将其功能表征为转录共激活因子。
随着20世纪80年代越来越多蛋白被克隆,一个重要进展是设计将不同合作伙伴与目标蛋白连接的融合蛋白。这些合作伙伴(或称“标签”)是可以通过亲和层析一步纯化的肽或蛋白。1988年首次报道了两种这样的融合伙伴:谷胱甘肽-S-转移酶(GST)和麦芽糖结合蛋白(MBP)。通过谷胱甘肽或直链麦芽糖柱结合后,分别用谷胱甘肽或麦芽糖洗脱,能够获得本征形式的GST或MBP融合蛋白。此后,许多其他蛋白标签被引入,包括能结合固定化免疫球蛋白G(IgG)的金黄色葡萄球菌蛋白A、结合镍或钴柱的多组氨酸序列,以及用于免疫纯化的小肽标签(如针对流感病毒血凝素(HA)蛋白的优良抗体)。
在上千次此类实验中,绑定在琼脂糖珠上的融合蛋白与细胞提取物混合,用于“拉下”相互作用蛋白。例如,1990年在癌症生物学实验中,重组SH2结构域与大肠杆菌TrpE蛋白融合并与固定化TrpE抗体结合的珠子一起,成功拉下了被酪氨酸磷酸化的表皮生长因子(EGF)受体和血小板衍生生长因子(PDGF)受体。
免疫共沉淀或拉下实验识别PPIs的局限性
尽管这些方法为基础生物学和疾病生物学提供了重要的基础性结果,但免疫共沉淀比蛋白质亲和层析更难扩展到多蛋白研究,因为它不仅要求目标蛋白的高度纯化,还需要制备高特异性的抗体,这常常十分困难。此外,抗体可能会干扰目标蛋白组装到蛋白质复合物中的过程。
无论使用何种标签,拉下实验可能会因融合伙伴阻碍目标蛋白与一个或多个伙伴的相互作用,或者阻碍其组装到蛋白质复合物中而失败。同时,在基因组测序出现之前,克隆编码目标蛋白的基因或cDNA既缓慢又繁琐,需要纯化蛋白,并通过抗体筛选表达文库或基于肽序列的寡核苷酸筛选DNA文库。此外,过表达的融合蛋白在大肠杆菌中可能是可溶的,但往往并非如此,尤其是对于缺乏翻译后修饰(PTMs)、伴侣蛋白或二者兼缺的真核蛋白。为解决这些问题,后来开发了在昆虫、酵母、哺乳动物细胞及其他系统中过表达蛋白的系统。
无论是使用蛋白质亲和层析、免疫共沉淀,还是标签方法,在基因组序列和质谱(MS)鉴定蛋白出现之前,识别相互作用蛋白及其功能和生物学相关性始终是一个巨大的挑战。
通过细胞内标记、AP和MS识别PPIs的见解:AP-MS
引入质谱技术识别相互作用蛋白
在20世纪90年代后期基因组测序完成之前,偶尔可以通过Edman降解法确定相互作用蛋白的N端氨基酸序列,并结合其cDNA已被克隆和测序的偶然机会,识别某些相互作用蛋白。然而,1988年开发出的两种软离子解吸方法——电喷雾电离(ESI)和基质辅助激光解吸电离(MALDI)——首次实现了质谱技术(MS)对包括肽和蛋白在内的大分子的质荷比(m/z)进行测定。这项突破使得1993年通过胰蛋白酶等氨基酸特异性蛋白酶消化后获得的肽段质量可以通过MS测定,并与DNA或氨基酸序列数据库比对,从而识别目标蛋白。液相色谱-串联质谱(LC-MS/MS)的开发进一步提高了复杂混合物中肽段的识别能力,为大规模蛋白质组学研究铺平了道路。
细胞内蛋白标记与AP结合
通过在天然宿主细胞中表达带有标签的蛋白,然后使用结合标签的固定化试剂纯化目标蛋白及其相互作用蛋白以供MS分析,这种方法具有多个优势。首先,使用天然宿主细胞可以避免异源系统中过表达蛋白导致的不溶性问题。其次,带标签的蛋白能够获得天然的翻译后修饰(PTMs),这些修饰可能影响其溶解性或与其他蛋白的结合。再次,在天然伴侣蛋白和辅伴侣蛋白的存在下,目标蛋白能够正确折叠。最后,通过将标签DNA整合到编码目标蛋白的基因中,标签蛋白可以以天然水平表达,从而避免因过表达导致的假性相互作用。
AP-MS的生物学见解
在酿酒酵母和大肠杆菌中,细胞内染色体蛋白标记和串联亲和纯化(TAP标签)技术使得可以对几乎所有蛋白进行AP-MS研究。这种系统化的基因组范围PPIs和蛋白复合物鉴定提供了许多重要生物学见解。例如,研究揭示了染色质生物学中的多个机制,包括COMPASS复合物(首个被纯化的组蛋白甲基转移酶复合物)介导的组蛋白甲基化、SET3复合物介导的组蛋白去乙酰化、以及Rpd3组蛋白去乙酰酶在启动子和转录区域中的不同功能。此外,研究还发现了特化的染色质重塑复合物,能够用组蛋白H2A的变体Htz1替代原有组蛋白。
在多细胞动物中,AP-MS技术结合现代质谱和生物信息学方法,使得能够鉴定目标蛋白及其相互作用蛋白。以果蝇和人类细胞系为例,研究生成了多达5,000种蛋白的PPIs网络。这些研究不仅促进了对疾病相关信号通路的理解,还揭示了多种蛋白修饰在调节PPIs中的重要作用,例如Hippo信号通路中由STRIPAK激酶复合物介导的磷酸化依赖相互作用。
AP-MS的局限性
尽管AP-MS技术强大,但其也有一些局限性。首先,标记蛋白的过表达可能导致伪相互作用;尽管利用CRISPR技术进行细胞内染色体标记可以避免这一问题,但当前仅限于少量目标蛋白。其次,某些生理相关但较弱的相互作用可能在AP清洗步骤中解离,因而无法检测到。此外,使用全细胞提取物的所有方法都面临一个共同问题,即某些蛋白在体外可能发生相互作用,但在体内由于定位或表达时序的差异,实际上无法相互作用。对于膜蛋白,其不溶性增加了识别的挑战,目前使用温和的去污剂可以解决部分问题。
尽管如此,AP-MS技术为研究PPIs提供了重要工具,并通过与其他技术结合,进一步推动了对生物学和疾病机制的理解。
通过CF-MS表征蛋白质复合物的生物学见解
CF-MS的工作原理
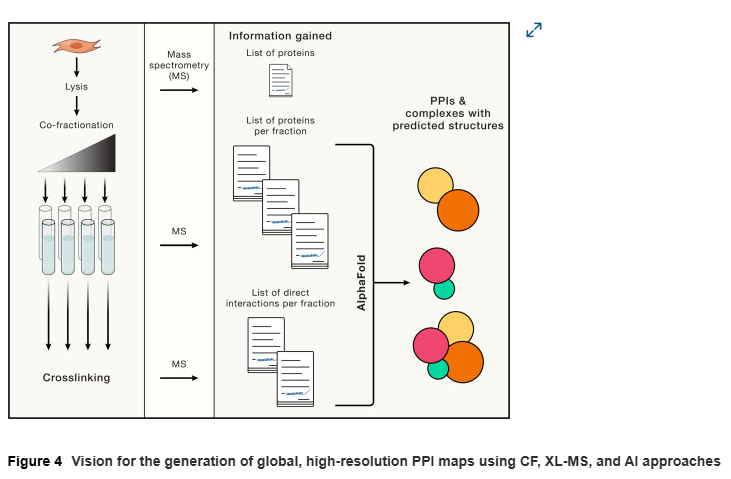
在早期的蛋白质纯化研究中,如果多肽在多步纯化过程中共同分离,通常被认为可能属于同一蛋白质复合物。这一原则被用于开发共分级-MS(CF-MS),该技术通过色谱分级后对蛋白质进行胰蛋白酶消化,并通过串联质谱(MS/MS)识别和定量。分级方法包括高分辨率离子交换色谱、分子排阻色谱、等电聚焦和疏水相互作用色谱,以及它们的组合。利用算法检测共同洗脱的蛋白,推测其可能属于同一蛋白质复合物。例如,对小鼠脑中多达8,389种蛋白的CF-MS分析,推测了1,030种蛋白质复合物,其中近40%为新发现。这些复合物中包括与肌萎缩侧索硬化症(ALS)相关的蛋白质组成的复合物,涉及剪接功能,并在ALS小鼠模型中发生改变。类似地,研究发现了在巨噬菌体感染的细菌中与捕食相关的许多新型病毒与宿主之间的PPIs。
CF-MS的优势与局限性
CF-MS无需对宿主或病原体的所有蛋白进行标记或纯化即可分析其相互作用,这使其特别适合研究病原体感染的细胞。同时,该方法能够揭示病原体对宿主PPI网络及蛋白复合物的间接影响。然而,由于共纯化的蛋白可能是偶然结合,CF-MS识别的PPIs和蛋白复合物需与已知数据进行对比验证。此外,MS技术本身难以检测细胞或组织中所有的蛋白,这一限制随着技术进步正在逐步改善。
另一个问题是单个蛋白可能在不同色谱图的多个峰中出现,这可能反映其存在于多个复合物中,或者在色谱分级过程中复合物部分解离。尽管如此,与AP-MS相比,CF-MS避免了因标签或抗体引入的潜在复合物破坏问题。此外,CF-MS可以利用质量标签(如SILAC或SWATH-MS)进行多样本定量比较,提高通量并减少仪器使用时间。
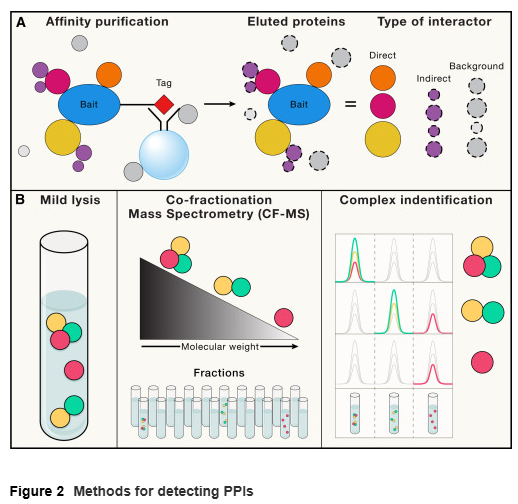
PPIs的验证及区分直接和间接相互作用
对于通过高通量方法(如AP-MS或CF-MS)识别的PPIs,进一步研究或开发治疗方法前需进行验证。可信的PPIs通常表现为在遗传研究中属于同一生物学系统、定位于同一细胞内区室,或在不同细胞类型和干扰条件下表达量高度相关。最常见的验证方法是免疫沉淀-免疫印迹法(IP-Westerns),但这种方法无法排除PPIs是否由其他蛋白或核酸介导。此外,FRET和BRET、近距离连接检测(PLA)以及生物素标记技术(如BioID和TurboID)等方法也可用于检测体内相互作用。
然而,这些方法通常难以区分直接和间接PPIs。针对这一问题,可以通过制备重组蛋白并在体外测试相互作用。此外,遗传方法(如酵母双杂交系统,Y2H)也被用于识别二元PPIs。Y2H方法虽然已筛选出大量人类蛋白的PPIs,但难以检测大复合物中的弱PPIs。
交联-MS(XL-MS)区分直接PPIs
交联-MS技术通过使用双功能交联试剂处理分离的蛋白质复合物并进行LC-MS/MS分析,可以可靠地识别复合物中邻近的肽段。这种方法不仅可以验证体内发生的PPIs,还能识别在AP过程中因清洗步骤而丢失的弱PPIs。此外,XL-MS能够明确介导相互作用的蛋白表面,为开发干扰PPIs的药物提供重要信息。当前正在开发更先进的方法以在蛋白质组范围内标记交联肽。
通过结合CF-MS、AP-MS和XL-MS等多种技术,研究者能够更全面地理解蛋白质复合物的组成和功能,为基础生物学研究和疾病治疗提供新的视角。
利用AP-MS研究野生型和突变型人类及病毒蛋白的疾病见解
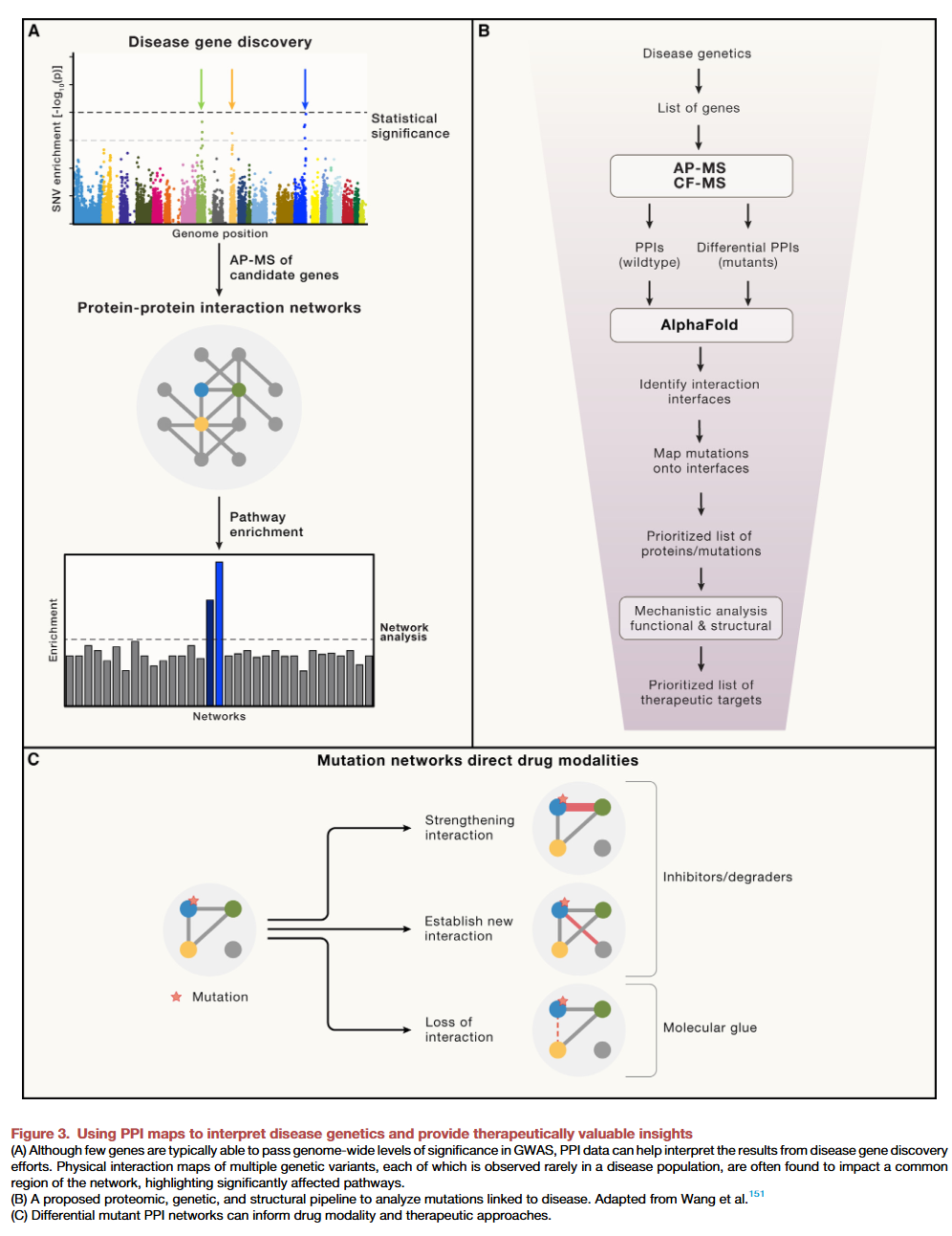
时间和空间中的PPI动态变化
近年来,研究蛋白质-蛋白质相互作用(PPIs)的时间和空间变化成为前沿课题。了解PPIs如何在细胞的不同区域中改变,以及在环境条件变化时随时间发生的动态变化,对解析细胞功能至关重要。例如,研究已经揭示了DNA损伤反应过程和干细胞分化过程中PPIs的变化。此外,还可以通过AP-MS技术探索与疾病相关的特定突变对PPIs的影响。
神经退行性疾病中的PPI研究
AP-MS已被用于构建与神经退行性疾病相关的蛋白网络,包括阿尔茨海默病(AD)、亨廷顿病和帕金森病。研究表明,突变型蛋白与其野生型蛋白相比,通常表现出不同的结合特性。例如,与早发型AD相关的突变型淀粉样前体蛋白(APP,K670N/M671L)显示其与线粒体呼吸链关键调控因子LRPPRC的相互作用发生改变。这一变化导致线粒体功能障碍,与AD相关表型一致,表明AP-MS方法可以揭示神经疾病的分子基础。
癌症突变中的PPI研究
差异性AP-MS实验也被用于分析多种致癌突变的影响,包括RAS的功能获得性错义突变和PP2A磷酸酶突变。对乳腺癌和头颈癌中最常见突变的系统分析揭示了许多突变和细胞类型特异的PPIs。例如,在头颈癌中,PIK3CA的两个常见突变(E542K和E545K)增强了PIK3CA与上游酪氨酸激酶HER3的结合力。更紧密的PIK3CA-HER3相互作用与体内对HER3抑制的更强反应相关,这表明PPI数据图谱可以直接影响临床治疗策略。
自闭症谱系障碍(ASD)中的PPI研究
类似的方法已应用于分析约100个与自闭症谱系障碍(ASD)相关的风险基因,发现了1,800个PPIs,其中大部分此前未被报道。通过引入54种患者来源的错义突变进行AP-MS分析,研究绘制了ASD突变的差异性相互作用图。例如,转录因子FOXP1的一个突变导致其与结合伙伴FOXP4的相互作用丧失,这与脑类器官中神经元亚板增多等表型一致,符合ASD的生物学特征。
高连通性与生物学收敛性
上述研究揭示了PPIs的生物学连通性和收敛性。通过将初始突变基因集合简化为一组较小的复合物和通路,PPI图谱帮助解释疾病基因的发现结果。相比单个基因水平的分析,将基因发现置于蛋白复合物和功能通路的框架下,可以更有效地捕捉生物学上的共性和机制。
病毒突变中的PPI研究
差异性AP-MS同样被用于评估病毒突变的影响。例如,对SARS-CoV-2主要变异株的突变系统研究揭示了病毒如何通过改变PPIs克服宿主防御机制以及治疗措施,从而更有效地劫持宿主。这些研究不仅深化了对病毒进化策略的理解,还为制定应对策略提供了重要依据。
蛋白质机器和复合物的生化解析与功能理解
随着时间和资源的积累,所有稳定组装的蛋白质复合物都可以通过亲和纯化(AP)分离,其蛋白组成通过质谱(MS)鉴定。尽管蛋白质复合物的亚基组成和功能可能因细胞类型而异,共分级-MS(CF-MS)能够揭示特定细胞类型中复合物的亚基组成,从而确定适合纯化每种复合物版本的细胞类型。然而,蛋白质复合物常以多种形式存在,即使在同一细胞中,不同版本的复合物可能具有不同但部分重叠的亚基组成。例如,在酿酒酵母中,Rpd3催化亚基参与了两种不同的组蛋白去乙酰酶复合物:Rpd3L复合物在特定启动子处抑制转录起始,而Rpd3S复合物则参与抑制转录区域中的非特异性转录起始。这些复合物通过传统的生化分级或在特异性亚基上添加AP标签得以解析,这表明互补的生化方法可用于解析包含重叠蛋白的复合物组成。
类似的复杂案例是人类SWI/SNF染色质重塑复合物(BAF复合物),其多种版本常见于癌症和神经发育障碍中。这些不同版本的BAF复合物可以通过生化和结构方法区分,为理解其功能提供了重要线索。
蛋白质复合物功能的优先研究
尽管获取蛋白质复合物列表是重要的第一步,但更关键的是解析这些复合物的功能。当数据不足时,可优先研究那些被怀疑为“蛋白质机器”的复合物。蛋白质机器通常由十个或更多基因产物组成,其功能依赖于能量驱动的单向构象变化,使其能充当分子马达、时钟或组装因子。蛋白质机器的动力源通常是高能键的水解(如ATP或GTP),因此保守的核苷酸结合位点可以帮助识别可能具有机器特性的复合物。这些复合物的不同构象状态(如结合ATP、ADP + Pi、ADP或未结合核苷酸)为其机器特性提供了依据。
研究蛋白质机器功能的方法
解析蛋白质机器功能的标准方法通常需要用纯化组分重建系统。这种方法结合使用蛋白标签简化了蛋白质的纯化过程,从而通过动力学和化学分析研究其不同组分的反应。蛋白质机器的多构象转换使其成为冷冻电子显微镜(cryo-EM)技术的重要研究对象。过去,研究者通过极为艰难的实验,分析复合物在不同状态间的转变。如今,通过亲和纯化将感兴趣的复合物直接捕获到冷冻电镜栅格上,极大地简化了实验过程。
最新的cryo-EM技术还能够从混合物中识别复合物的“构象景观”,结合ATP及模拟不同核苷酸结合状态的配体,进一步提高对新型蛋白质机器的理解。此外,经典的蛋白质亲和层析方法也可以用于筛选在结构分析中可能具有弱结合能力的“辅助蛋白”。
AI与Cryo-EM结合AP-MS和CF-MS对PPI靶向疗法开发的影响
解读PPI数据集中的突变效应
为了从差异性PPI数据集中提取生物学和治疗学价值,了解哪些突变通过直接影响特定界面来扰动PPI至关重要。然而,AP-MS数据的一大局限在于难以区分直接PPIs与通过其他蛋白介导的间接PPIs。虽然XL-MS和Cryo-EM能够解决这一问题,但前者缺乏全面性,后者操作繁琐,特别是在需要评估大量致病突变对PPIs的影响时。
人工智能(AI)技术的最新进展正在改变这一局面。例如,AlphaFold通过高精度预测蛋白质结构,已经能够成功预测PPIs。这些预测有助于筛选直接相互作用并优先研究与疾病相关的突变。例如,AlphaFold被用于分析自闭症相关蛋白的AP-MS衍生PPI,帮助鉴定了与疾病状态相关的新蛋白。基于这些预测,可以将直接PPI界面的突变优先用于基因研究和基于结构的Cryo-EM分析。
将PPI数据应用于治疗
PPI数据可以帮助识别新的治疗靶点并揭示如何“靶向”这些靶点。例如,与头颈癌相关的PIK3CA突变(如E542K和E545K)增强了其与HER3的相互作用,这表明抑制HER3功能可能是一种有效的治疗策略。而如果突变破坏了PPI,则通过分子胶恢复该相互作用可能具有潜在价值。类似地,PPI数据还可以用于开发双功能蛋白降解诱导剂(PROTACs)和分子胶降解剂。此外,AI技术可以帮助预测与PPI界面特异性作用的化合物,进一步推动精准治疗。
结论
过去,研究者试图从疾病相关的基因组测序数据中直接提取生物学和治疗学见解。然而,仅靠序列信息能够获得的见解有限,且针对特定疾病领域的进一步测序努力往往面临收益递减的问题。细胞的功能单元是蛋白质,它们通过物理相互作用“交流”,并最终组装成分子机器,这些相互作用几乎涉及细胞的所有功能。此外,与疾病相关的突变通常会扰乱蛋白质的功能及其相互作用,而目前用于治疗疾病的大多数药物也直接靶向蛋白质。因此,深入且机制化地理解蛋白质-蛋白质相互作用(PPIs)对于理解健康生物学及治疗疾病至关重要。
尽管PPI的研究已有近半个世纪的历史,但实验和计算方法整合的最新进展,为以高分辨率方式识别和表征稳态PPIs及受疾病突变影响的PPIs提供了前所未有的可能性。这些由数据驱动的整合管线产生的新视角,标志着PPI研究的新纪元,不仅将更深入地解析健康与疾病的分子生物学,还将为开发多种疾病的新型治疗方法提供关键基础。
整理 | WJM
参考资料
Greenblatt, J.F., Alberts, B.M. and Krogan, N.J., 2024. Discovery and significance of protein-protein interactions in health and disease. Cell, 187(23), pp.6501-6517.

