来源:雪球App,作者: CD-CLX,(https://xueqiu.com/1719878892/311983433)
亚盛在ASH2024目前最大的一个收获就是力胜克拉(APG-2575)在美国开展的一项Ib/II期RR-MM/RR-AL(难治复发多发性骨髓瘤和免疫球蛋白轻链淀粉样变)的试验获得了大会的口头报告,感觉有两点非常难得:
第一这个试验只是一个早期的剂量探索性试验,每个队列的样本量是非常有限的,结果却拿到了顶级大会的口头报告,
第二,这个试验在一年里已经连续三次在顶尖血液瘤大会上展示,第一次去年的ASH,然后今年的EHA以及最后是今年的ASH,说明这个试验受到了行业专家的关注和认可,以及对于这一领域未满足临床需求的迫切期待。
之前对MM不怎么了解,只听说过MM这个领域出了许多重磅药物,比如来那度胺,泊马度胺,达雷妥尤单抗,硼替佐米和卡非佐米等等,最近查看了一点资料才发现这个疾病领域治疗差异还是蛮大的,也有点不理解为何有限的疗效能够带来巨大的收入。那对于力胜克拉此次ASH摘要数据,还是要搞清楚为何在剂量爬坡阶段有限的数据能够拿到世界最顶尖血液瘤大会的口头报告:
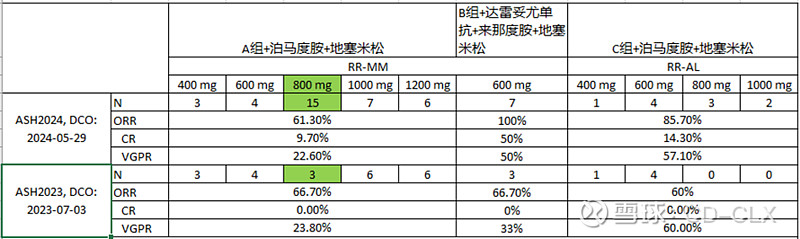
对比2023ASH和2024ASH披露得数据看,有以下感受:
· RR-MM A组联合泊马度胺和地塞米松的ORR还是相对稳定,ORR 60%多,说实话我刚刚开始看感觉太低了。
· RR-MM B组联合达雷妥尤单抗、来那度胺和地塞米松的ORR在ASH2024年达到了100%,而且都是VGPR以上,这个看着非常不错。
· RR-AL C组联合泊马度胺和地塞米松的ORR也很不错,ASH2024年为85.7%,VGPR以上超过70%。
· 从入组人数看,A组的剂量感觉已经差不多定在了800 mg,B组本来就是单一剂量600 mg,C组剂量还在往高的探索,感觉剂量更高疗效更好。
· 最后一点入组速度真是太慢了,现在应该可以加油搞了。
安全性方面感觉还是挺不错的,发热性粒缺还是蛮低的,中性粒减少症看起来也很不错,特别强调这个是因为发热性粒缺非常严重,有比较高的致死率,中性粒细胞减少往往跟严重感染相关,维奈克拉基本就是栽在这里了:
在安全性人群的49例患者中,34例 (69.4%) 报告任何级别的lisaftoclax治疗相关AE(TRAE;>=5%发生率),包括中性粒细胞减少症 (20.4%)、血小板减少症 (6.1%)、白细胞减少症 (10.2%)、恶心 (16.3%)、腹胀 (10.2%)、腹泻 (12.2%) 和便秘 (8.2%)。共有11例患者发生>=3级TRAE,包括中性粒细胞减少症 (14.3%) 和发热性中性粒细胞减少症 (2%),3例患者发生lisaftoclax相关严重AE(各1例):发热性中性粒细胞减少症、急性肾损伤和腹泻伴电解质失衡。在 B 组中,1例患者发生剂量限制性毒性(QT间期延长)。
看完了力胜克拉的早期剂量探索的疗效和安全性数据,再看看在不加L药时泊马度胺联合地塞米松在RR-MM的数据,看到这个数据我还是有点惊讶的:
下面这个试验一个II期试验(Trial 1),入组的是经来那度胺和硼替佐米治疗的患者,患者随机分配到泊马度胺以及泊马度胺加低剂量地塞米松组,前线治疗中位数5,属于重度治疗过的。泊马度胺联合低剂量地塞米松的ORR只有29%,CR率只有1%不到,泊马度胺单药组就更差了。
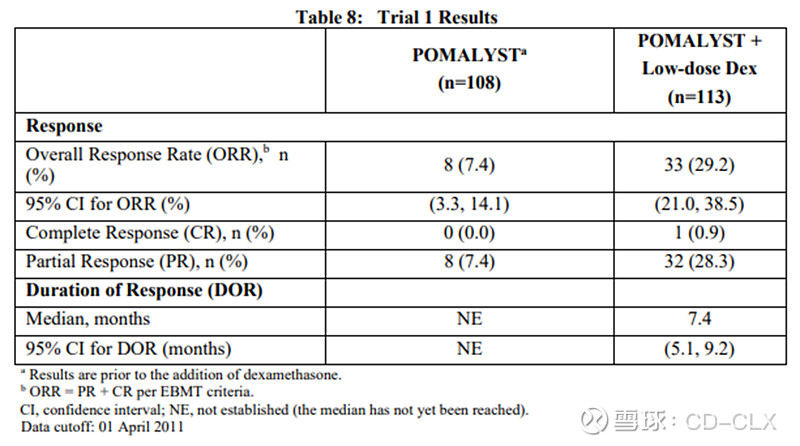
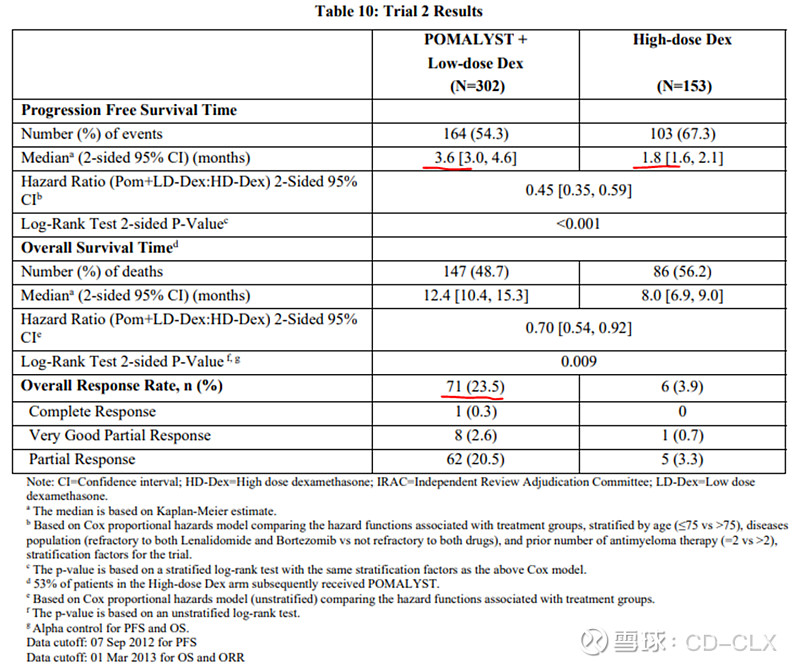
下面试验是一个III期阳性对照试验,泊马度胺联合低剂量地塞米松对比高剂量地塞米松,入组患者也是经来那度胺和硼替佐米治疗过的患者,前线治疗中位数5,属于重度治疗过的。III期结果跟II期差不多,ORR只有23.5%,几乎没有CR的患者,PFS也是非常低,只有3.6个月。
相对于B组,达雷妥尤单抗联合泊马度胺和地塞米松的疗效,下面的结果来自说明书中一项II期结果,入组人群也基本上是来那度胺和硼替佐米经治的患者,前线治疗中位数4线,属于重度治疗人群。ORR为59.2%,VGPR以上41%左右。ORR现在没法说加上L药咋样,虽然我对血液瘤少量样本数据也抱有比较大信心。不过很明显的是加上L药后疗效反应深度更好,疗效反应都是VGPR以上。另外为何至今说明书里没有III期试验的数据,FDA给豁免了?

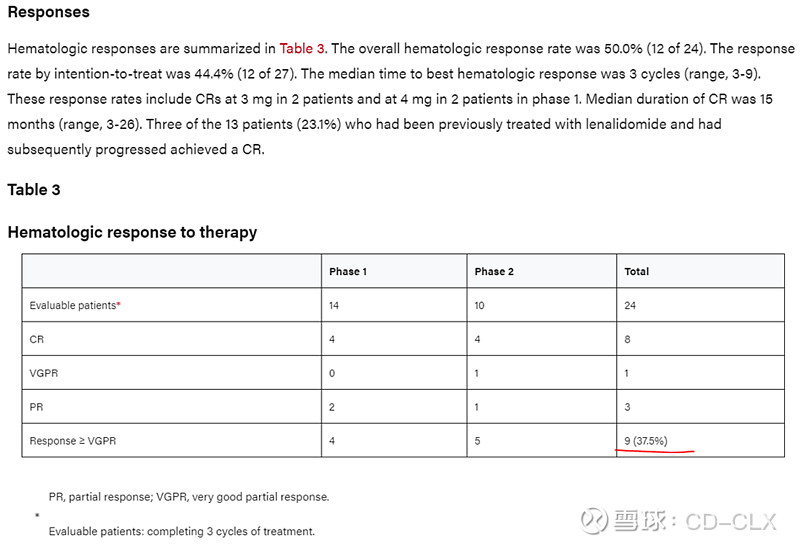
对于C组治疗,泊马度胺联合地塞米松的疗效看下面截图,也是一个剂量爬坡试验。前线治疗中位数2线,相对还好。ORR为50%,VGPR以上是37.5%。不过试验中出现了两例因为感染死亡的病例,看起来这个疾病以及相应的治疗也是蛮凶险的。


维奈克拉在RR-MM目前一无所获,下面是一些维奈克拉在RR-MM的试验结果
II期试验,维奈克拉也是联合泊马度胺和地塞米松,总共入组8个人,4人发生DLT,ORR为63%。

此外,维奈克拉毒性问题体现最明显的就是BELLINI试验。维奈克拉联合硼替佐米和地塞米松 vs 硼替佐米和地塞米松: 291名患者被随机分组;194名患者服用维奈克拉,97名患者服用安慰剂,因为试验组死亡风险是对照组的两倍,试验因此被FDA叫停,同时FDA还暂停了同期正在进行的其他RR-MM的试验。截至2019年9月13日,59名患者仍在试验中治疗,其中45名(23%)接受维奈克拉治疗,14名(14%)接受安慰剂治疗。中位随访期为28.6个月,维奈克拉组有64例(33%)死亡,安慰剂组有24例(25%)。初始数据日期(2018年11月26日)截止时,无进展生存期HR为0.63(0.44,0.90),总生存期HR为2.03(1.04,3.95)。维奈克拉最常见的治疗相关性不良事件(TEAE)为腹泻(59%)、恶心(37%)和便秘(35%)。最常见的3/4级不良事件为中性粒细胞减少(21%/8%)、血小板减少(15%/30%)、贫血(16%/15%)、腹泻(15%/12%)和肺炎(18%/13%)。54%的维奈克拉组患者和52%的安慰剂组患者出现严重不良事件。24%的患者因不良事件停用维奈克拉,12%的患者停用安慰剂。维奈克拉组有14例因治疗而死亡,安慰剂组有1例因治疗而死亡。
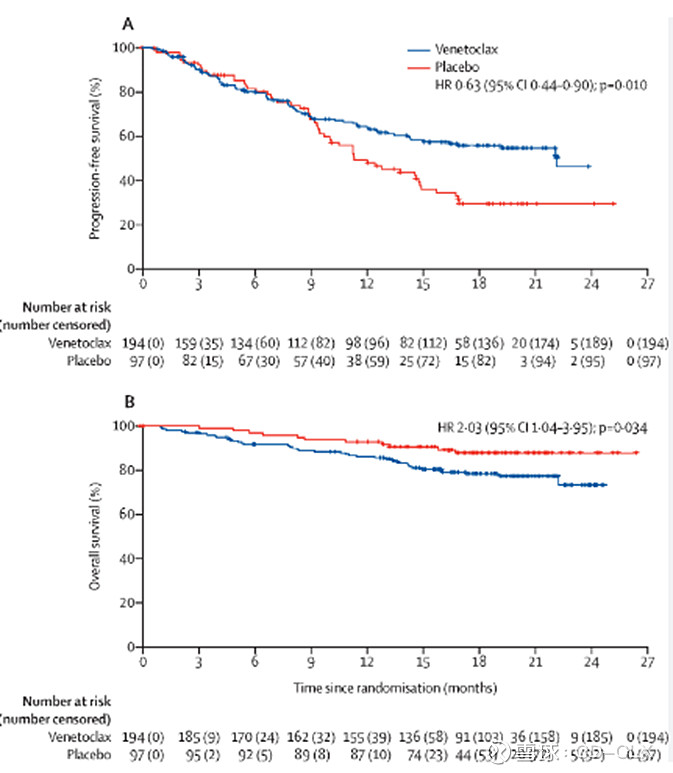
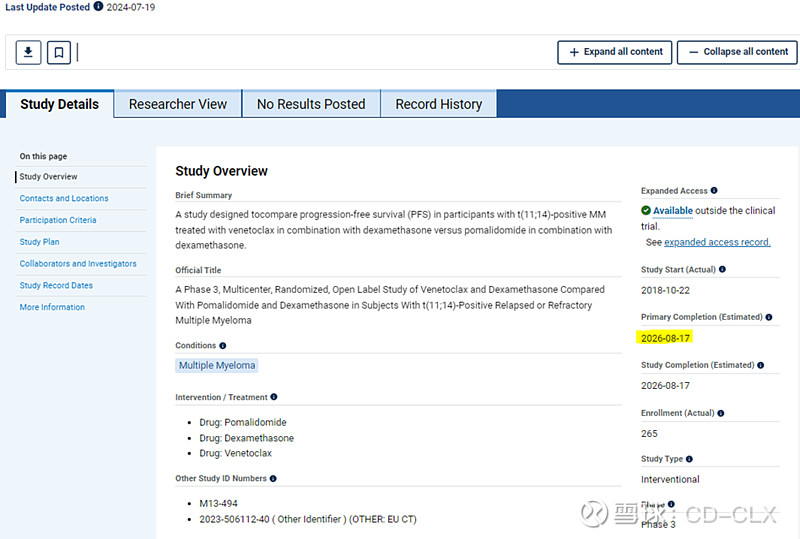
此外,维奈克拉正在进行的一项III期试验也是颇为坎坷,针对t(11;14)【11和14号染色体易位】。
A Study Designed to Evaluate the Safety and Efficacy of Venetoclax Plus Dexamethasone (VenDex) Compared With Pomalidomide Plus Dexamethasone (PomDex) in Participants With t(11;14)-Positive Relapsed or Refractory Multiple Myeloma.
代号CANOVA
2018-10-26 首例入组,计划入组244
2019-03-19 因为BELLINI Phase III试验被暂停
2019-06-17 试验重启
2021-01-15 PFS观察世间从28个月延长到43个月, OS从37个月到51个月
2022-07-19 入组完成, 实际入组254
2022-11-08 入组重启, 计划入组244
2023-02-24 加入一个美国人队列, 计划入组294
2023-07-20 美国队列删除, 计划入组244
2024-02-18 入组完成, 最终入组265
试验预计2026年8月读出最终OS数据
最后提以下百济的BGB-11417,BGB-11417目前也只是开展了针对针对t(11;14)RR-MM的试验,因为BELLINI试验里观察到的亚组数据显示有非常明显的优势。

对于CAR-T,没啥可说的,目前疗效就是碾压性的,但是患者还是会疾病进展,后线也还是有机会,而且能进行CAR人群应该也不大,后面进一步学习。

